第十一讲:化学反应速率与化学平衡
时间:2021-04-20 15:21 来源:高中化学教学研究 作者:张德金 点击: 次 所属专题: 速率与平衡
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
平衡现象是自然界中普遍存在的现象,小到微观世界中的原子、分子甚至更小,中到生态系统、地表系统等自然体系和经济体系、历史演化等人类活动,大到星系、宇宙等,都存在着平衡与失衡的相互演化。
化学反应的可逆性是化学反应中存在的普通现象,绝大多数反应都是可逆的。只是一些反应进行得比较完全,我们就把这样的反应定位到了不可逆反应。所有的可逆反应,反应到最后,都是达到了化学平衡状态。
反应速率可以用来解释化学平衡产生的原因。化学工业生产的效率不仅要考虑反应的速率,还要考虑反应物的转化率。而化学平衡是可以移动的,转化率是可以改变的。
这一部分主要讲了化学反应速率的定义,化学反应速率的影响因素,化学平衡,化学平衡的移动,化学平衡常数,化学反应的自发性,等效平衡。
1、化学反应速率的定义
(1)化学反应速率肯定表示的是化学反应的快慢。但快慢不能只是用感觉说,要用数据和计算来表达才可以。
如果只是用反应物的物质的量与时间的比值来表示,存在的问题是,整个地球上每秒钟都有上千万吨的铁被氧化掉,可是我们却感觉不到铁在迅速被氧化。
所以,除了物质的量与时间,我们还需要限定空间。而物质的量与空间的比值是浓度。这样就得到了反应速率的计算式:
反应速率=反应物或生成物的浓度变化量/时间变化量
ν=Δc/Δt
单位是一般用mol/(L·min)或mol/(L·s)。
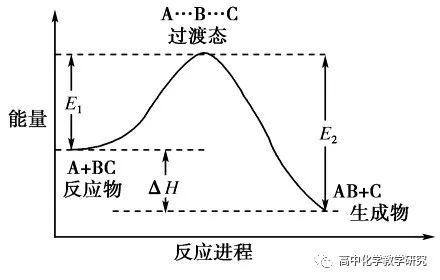
例如,在2L 密闭容器中发生反应,N2+3H2⇌2NH3,若5min内N2的物质的量从8mol 降到6mol,求这段时间内N2的平均反应速率。
解:Δc=(8mol-6mol)/2L=1mol/L
Δt=5min
ν=Δc/Δt=(1mol/L)/5min=0.2 mol/(L·min)
(2)进行化学反应速率计算时,注意的问题是:
①这种计算只针对有均匀浓度的物质。在气体反应体系中固体或液体的反应速率无法这样表达。
②用反应方程式的系数比,可以得到其它物质的反应速率。对于反应物来说,指的是消耗速度。对于生成物来说,指的是生成速率。
2、化学反应速率的影响因素
(1)对于一个确定的反应来说,反应速率受浓度、温度、催化剂、固体表面积等因素影响。
不可逆反应的反应速率由反应物浓度决定,与生成物的浓度无关。可逆反应注意区分总的反应速率、正反应速率、逆反应速率。
生活经验就能告诉我们,扩大反应物的接触面积(粉碎或搅拌),提高反应物的浓度,提高温度,都能加快反应速率。化学经验也让我们知道,使用催化剂能大大加快反应速率。
需要注意的是气体体系增大压强时,若体积缩小,反应速率加快。本质是因为体积缩小后,浓度提高造成的。
像N2与H2反应生成NH3的恒容密闭容器,若充入He造成压强增大,反应速率是不会加快的。
①活化能改变了对化学反应历程的解释。
新的解释是:在化学反应中,普通分子首先吸收活化能变为活化分子,活化分子相互反应生成产物释放能量。
②提高反应物浓度时,活化分子的百分率没有发生变化,但活化分子浓度有提高,有效碰撞机率增大,反应速率加快。(有效碰撞是指能发生反应的碰撞)
提高体系温度时,有更多的普通分子吸收能量转化为活化分子,活化分子的百分率增大,活化分子浓度提高,分子运动速度加快,有效碰撞机率增大,反应速率加快。
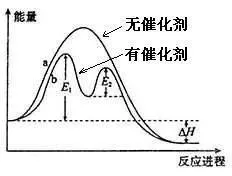
使用催化剂时,催化剂改变了反应历程,降低了活化能,更多的普通分子吸收能量转化为活化分子,活化分子的百分率增大,活化分子浓度有提高,有效碰撞机率增大,反应速率加快。
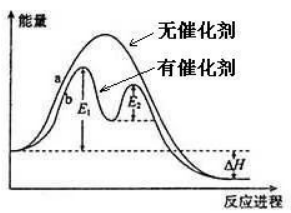
(3)催化剂的一般催化原理
若反应方程式为A+B=C,催化剂为M。
使用催化剂后,反应方程式变为:
①A+M=X
②X+B=C+M
经过两次反应后,最后结果与不加催化剂时相同。如果①②的活化能都比不加催化剂的反应小很多,则反应速率会大大加快。
(4)教材中关于反应速率的实验
用不同浓度的草酸(H2C2O4)与定量的酸性KMnO4反应,证明反应速率受浓度影响。反应方程式为5H2C2O4+2KMnO4+3H2SO4=10CO2↑+K2SO4+2MnSO4+8H2O。
用不同温度的Na2S2O3与稀H2SO4的混合液反应,证明反应速率受温度影响。反应方程式为Na2S2O3+H2SO4=Na2SO4+S+SO2↑+H2O。
用不同温度的KI与稀H2SO4的混合液反应,证明反应速率受温度影响。反应方程式为4KI+O2+2H2SO4=K2SO4+2I2+2H2O。
用不同催化剂(FeCl3溶液、CuSO4溶液、固体MnO2)催化H2O2,看催化剂对反应速率的影响。反应方程式为2H2O2=催化剂= 2H2O+O2↑。
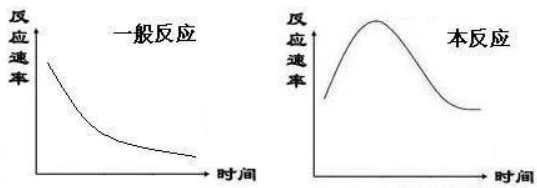
用MnSO4催化剂催化草酸与酸性KMnO4的反应,证明反应速率受催化剂影响。此反应还是一个产生催化剂的反应,反应速率随时间的变化图像很特殊。
3、化学平衡
化学平衡是可逆反应达到限度(最大程度)时的一种现象,是一种动态平衡。
(1)可逆反应:在同一反应条件下既可以正向反应,也可以逆向反应。
正向反应的反应速率由反应物的浓度决定,逆向反应的反应速率由生成物的浓度决定。
正向反应的反应速率可以由反应物的消耗速率或生成物的生成速率表示。逆向反应的反应速率可以由生成物的消耗速率或反应物的生成速率表示。
(2)化学平衡
当同一物质的ν正=ν逆时,浓度不再发生变化,反应达到平衡状态。
ν正=ν逆:对于反应物来说是指同一反应物的消耗速率等于生成速率,对于生成物来说是指同一生成物的生成速率等于消耗速率。
化学平衡是动态平衡,正逆反应都仍然在进行。
(3)要学会求体积分数、转化率、分压、平均相对分子质量、密度等。一般用“三段法”解题。
“三段法”是使计算数据变得清晰化、条理化的重要方法。
例如,在2L 体积不变的密闭容器中发生反应,N2+3H2⇌2NH3,若开始时N2和H2的物质的量分别为8mol,4mol,此时的压强为12MPa,达到平衡时,N2反应掉了1mol,求①达到平衡时H2的体积分数,②N2的转化率,③反应后的体系压强,④N2的分压,⑤混合气体的平均相对分子质量,⑥混合气体的密度。
解:三段法
N2+3H2⇌ 2NH3
反应前:8mol 4mo l 0mol
过程中:-1mol -3mol +2mol
反应后:7mol 1mol 2mol
①体积分数:自己的体积占总体积的百分比,用自己的物质的量除以所有气体的物质的量的和。
H2的体积分数:1mol/(7mol+1mol +2mol)=10%
②转化率:用自己反应掉的物质的量除以自己反应前的物质的量。
N2的转化率:1mol/8mol=12.5%
③体系的压强:体系反应前后的压强之比等于气体的总的物质的量之比。
反应后的总压:12MPa×10mol/12mol=10MPa
④分压:自己在体系中产生的压强,用总压乘以自己的体积分数得到。
N2的分压:10MPa×[7mol/(7mol +1mol +2mol)]=7 MPa
⑤混合气体的平均相对分子质量:相当于气体分子的平均质量,用总质量除以总的物质的量得到。
(7mol×28g/mol+1mol×2g/mol+2mol×17g/mol)/(7mol+1mol+2mol)=232g/10mol=23.2g/mol
平均相对分子质量没有单位,答案为23.2。
⑥混合气体的密度:
232g/2L=116g/L
4、化学平衡的移动
当改变反应条件时,化学反应的平衡状态有可能被破坏,体系不再处于平衡状态。但体系会自动正向或逆向移动,重新达到平衡状态。
体系的这种自动正向或逆向移动,是有规律的,这个规律叫化学平衡移动原理,又叫勒夏特列原理。
(1)勒夏特列原理及应用
勒夏特列原理:如果改变影响平衡的条件之一(温度、浓度、压强),平衡将向着能够减弱这种改变的方向移动。
对于勒夏特列原理的含义,需要用示例不断体验,慢慢感受,就能掌握。
例如,在密闭容器中存在化学平衡,N2+3H2⇌2NH3ΔH<0。
①若再加入少量N2,体系会向消耗N2的方向移动,即正向。
②若减少H2,体系会向生成H2的方向移动,即逆向。
③若增大压强缩小体积,体系会向减小压强的方向移动,也就是向气体分子数变小的方向移动,即正向。
④若提高温度,体系会向降温的方向移动,也就是吸收热量的方向移动,即逆向。
注意,催化剂不会造成化学平衡移动。
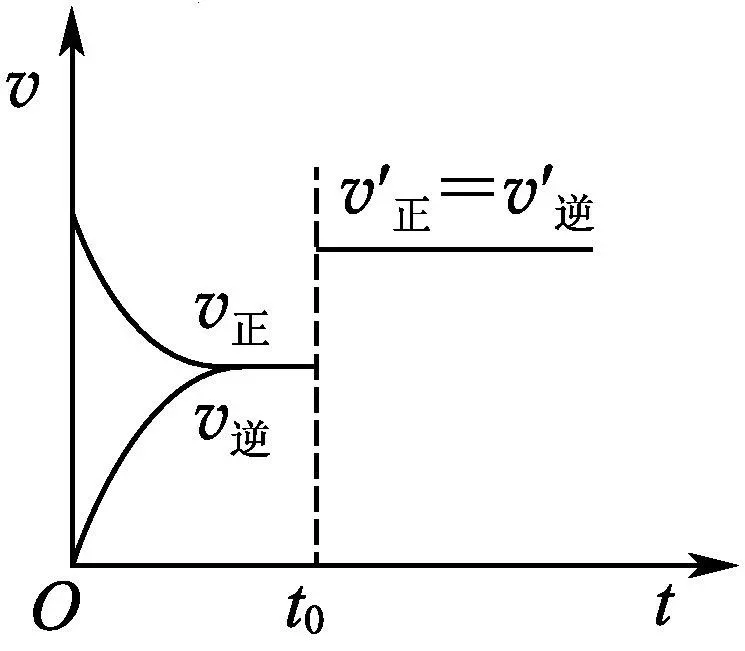
(2)会用反应速率变化解释勒夏特列原理或用勒夏特列原理推理反应速率的变化。
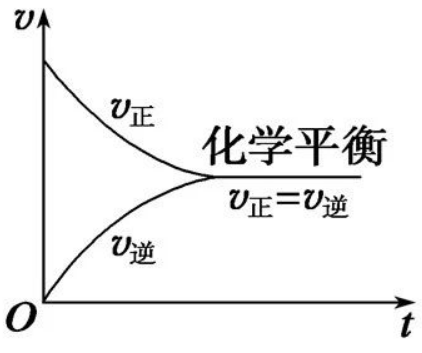
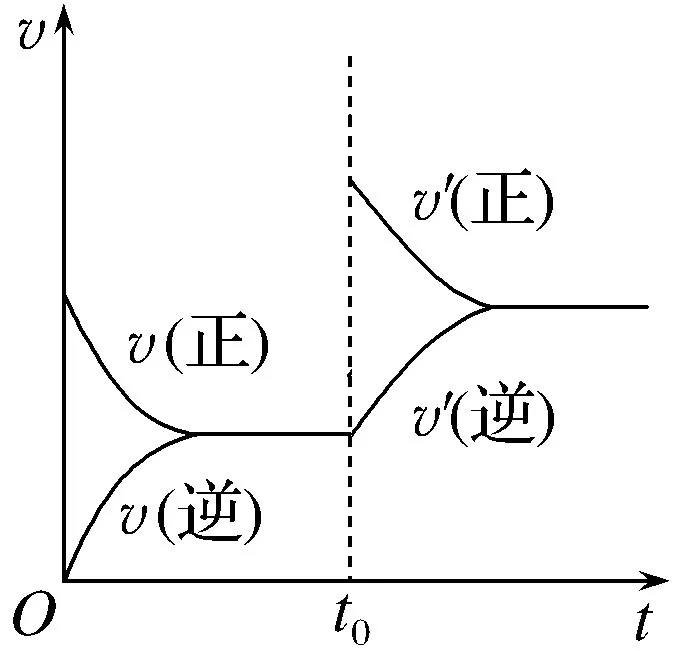
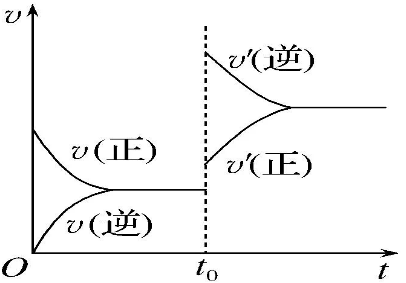
①接(1)中的例子,t0时再加入少量N2,N2的浓度提高,正反应速率加快,逆反应速率不变,ν正>ν逆,平衡正向移动。
②t0时提高温度,对于正、逆反应,反应速率都加快。又根据ΔH<0,推理出平衡逆向移动,说明ν正<ν逆。
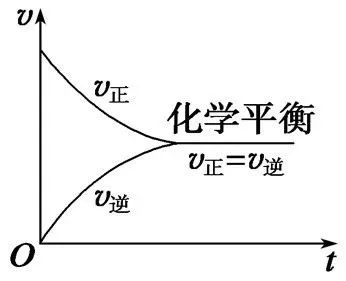
③t0时加入催化剂,催化剂不会平衡移动。说明催化剂同等程度地增加正反应速率和逆反应速率,ν正=ν逆。
(3)关于达到平衡的标志
总的判断方法是:达到平衡之前在体系中不断变化的量,如果不变了,就表示达到平衡了。
对于恒温恒容体系、恒温恒压体系、绝热恒容体系,同一种数据在不同的体系中,说法会有所不同。
比如,压强在恒温恒压体系中不是达到平衡的标志。压强在恒温恒容体系中一般是,但对反应前后气体分子总数相等的反应就不是。压强在绝热恒容体系中基本都是。
注意在达到平衡的过程中,体系的体积、压强、温度是否变化。熟练掌握三段法计算,掌握体积分数、转化率、体系压强、分压、平均相对分子质量、密度的计算等,这个问题才能解决。
(4)教材中关于化学平衡移动的实验
①Cr2O72-(橙色)+H2O⇌2CrO42-(黄色)+2H+。
加酸,平衡逆向移动,溶液变橙色。加碱,平衡正向移动,溶液变黄色。
②Fe3++3SCN-⇌Fe(SCN)3(红色)
加FeCl3,平衡正向移动,红色变深。加KSCN,平衡正向移动,红色变深。加NaOH,消耗Fe3+,平衡逆向移动,溶液红色变淡。
③2NO2(红棕色)⇌N2O4(无色)ΔH=-56.9kJ/mol
升温,平衡逆向移动,红棕色加深。降温,平衡正向移动,红棕色变淡。
5、化学平衡常数
化学平衡常数是化学平衡体系的一个神奇存在。它决定了可逆反应在体系中反应到什么程度时达到平衡。其它的平衡体系应该也有平衡常数,只是如果决定因素很多,得到它特别复杂,那意义就不大。不过有些简单的平衡体系还是值得研究。
(1)化学平衡常数的表达式及计算:
当一个可逆反应达到平衡时,生成物浓度的幂之积与反应物浓度的幂之积的比值是一个常数,这个常数就叫化学平衡常数。(幂的指数为方程式的系数)
以平衡体系N2+3H2⇌2NH3ΔH<0为例
K=c2(NH3)/c(N2)·c3(H2)
若平衡后N2、H2、NH3的各为7mol、1mol、2mol,体系的体积为2L,则N2、H2、NH3的浓度分别为3.5mol/L、0.5 mol/L、1mol/L。
K= (1mol/L)2/3.5mol/L×(0.5mol/L)3=16/7(mol/L)-2
(2)只要温度一定,化学平衡常数是一个定值。
①它不随浓度、压强、催化剂、表面积等的变化而变化。
②它只受温度影响。对于放热反应(ΔH<0),升温时,K减小,降温时,K增大。对于吸热反应(ΔH<0),则反之。
(3)化学平衡常数表达式书写时注意的问题
①表达式中只写入在平衡体系中均匀分布且参与反应的物质。
例如
气体体系中发生C+H2O(g)⇌CO+ H2,达到平衡。C不在体系中均匀分布,所以表达式为K= c(CO)·c(H2)/c(H2O)。
水溶液体系中发生AgCl+KI⇌AgI+KCl,达到平衡。KI、KCl溶于水,在体系中均匀分布,所以表达式为K= c(KCl)/ c(KI)。
水溶液中的微溶性物质,若用的是它的澄清水溶液,则写入。若用的浊液,则不写入。
②溶液体系中若溶剂参与反应,一般在表达式中不写。不写的原因是,在形成平衡的过程中,溶剂的浓度几乎没有变化,是一个常数,它可以和平衡常数一起形成一个新常数。
如H2O⇌OH-+H+。
水的离子积常数表达式为Kw=c(H+)·c(OH-)。
盐的水解常数Kh也是不写的。
所以化学平衡常数表达式中写入的是在体系中均匀分布的,参与反应的,且有浓度变化的物质。
③压强平衡常数。
我们平时书写的平衡常数,是指浓度平衡常数KC。用浓度计算得到。
在气体体系中还经常用到另一种平衡常数KP,压强平衡常数,用分压计算得到。KP的表达式与KC的相似。只是计算时用的分压。
以平衡体系N2+3H2⇌2NH3为例,压强平衡常数表达式为:
Kp= p2(NH3)/p(N2)·p3(H2)
若平衡后N2、H2、NH3的物质的量各为7mol、1mol、2mol,平衡后的体系的压强为10MPa,则N2、H2、NH3的分压分别为7 MPa、1 MPa、2 MPa。(分压=总压×体积分数)
Kp= (2 MPa)2/7 MPa×(1 MPa)3=4/7 (MPa)-2
(4)用化学平衡常数计算化学平衡移动方向
例如,反应N2+3H2⇌2NH3ΔH<0达到平衡时,N2的浓度为1mol/L,H2的浓度为1mol/L,NH3的浓度为1mol/L。
计算得K= c2(NH3)/c(N2)·c3(H2)=c(1mol/L)2/1mol/L·c(1mol/L)3=1(mol/L)-2。
①若将N2的浓度提高到2mol/L,若平衡不移动,则K为1/2(mol/L)-2,不符合平衡常数不变。要想平衡常数不变,需要提高NH3的浓度,降低N2和H2的浓度,平衡就会正向移动。所以提高N2的浓度,反应向消耗N2的方向移动。
②若将压强提高到2倍,体积缩小到原来的一半,浓度会都变为原来的2倍,N2的浓度为2mol/L,H2的浓度为2mol/L,NH3的浓度为2mol/L。若平衡不移动,则计算K为1/4(mol/L)-2,不符合平衡常数不变。要想平衡常数不变,需要提高NH3的浓度,降低N2和H2的浓度,平衡就会正向移动。所以增大压强,平衡向正向移动,也就是气体分子数减小的方向移动。
③若将温度提高,浓度如果不变,则K不变,不符合对于ΔH<0的反应,升高温度时,K减小。要想平衡常数减小,需要降低NH3的浓度,升高N2和H2的浓度,平衡就会逆向移动。所以升高温度,对于ΔH<0的反应(放热反应),平衡逆向移动,也就是升温,向吸热的方向移动。
所以,勒夏特列原理的原因是化学平衡常数,勒夏特列原理可以用计算得到。
6、化学反应的自发性
(1)什么是熵(S)和熵变(ΔS)
熵(S),指的是混乱程度。越混乱时,S越大。
体系变得更混乱时,ΔS>0。体系变得更整齐时,ΔS<0。
(2)ΔH、ΔS对自发性的影响
ΔS>0时,物质变得更混乱,是容易的,是趋向于自动发生的。
ΔS<0时,物质变得更整齐,是困难的,是不趋向于自动发生的。
ΔH<0时,反应放热,是容易的,是趋向于自动发生的。
ΔH>0时,反应吸热,是困难的,是不趋向于自动发生的。
(3)反应是否自发有两个决定因素,ΔH和ΔS。
①ΔH<0、ΔS>0时,反应肯定自发进行。
②ΔH>0、ΔS<0时,反应肯定不自发进行。
当ΔH<0、ΔS<0或ΔH>0、ΔS>0时,是不一定的。所以引入一个新的计算式,ΔG为吉布斯自由能的变化。T为热力学温度,T=(273.15+T)K(T为摄氏度数据)。
ΔG=ΔH-T·ΔS
当ΔG<0时,化学反应会自发进行。当ΔG>0时,化学反应不会自发进行。
③ΔH<0、ΔS<0时,反应在低温下自发进行。
④ΔH>0、ΔS>0时,反应在高温下自发进行。
(4)会判断一个反应是什么样的自发可能
物质从固体变为液体,再变为气体时,混乱度是变大的,ΔS>0。
比如,CaCO3=CaO+CO2↑ΔH>0。此反应固体变为一部分气体,ΔS>0。又因为ΔH>0,所以是高温自发的反应。
C+O2=CO2,此反应固体变为气体,ΔS>0。又是燃烧反应,ΔH<0,所以是肯定自发的反应。
即使反应能够自发进行,并不意味着这个反应肯定就会发生。判断反应的自发性只是判断了没有外界干扰时的反应的可能,如果允许外界施加作用,就会出现相反结果。
7、等效平衡
别把等效平衡想难了,就是比较化学反应相同的两个平衡体系而已。若两个体系的温度相同,初始的成分或浓度不同,达到平衡后成分和浓度都相同,则这两个体系为等效平衡体系。(温度不同的体系不可能形成等效平衡体系,因为平衡常数不同,不可能所有的物质的浓度都相同)
(1)等效平衡的分类
①等体积等效平衡体系:
若两体系的体积相同,平衡时浓度也相同,则平衡时物质的量也相同。所以下面这四个体系都是等效平衡体系。
②等压强等效平衡体系:
若两体系的体积不同,平衡时浓度相同,则体积大的体系平衡时物质的量也大。所以,下面这四个体系都是等效平衡体系。
仔细琢磨各体系的数据之间的关系。
还有一种特殊的等效平衡体系,反应前后气体分子总数相等的反应,在等温等体积体系中,物质的量不相等,也可以形成体积分数相等的相似体系。
(2)等效平衡的应用之一:充气问题
在固定体积的密闭空间中,充入一定量的N2和H2,达到平衡后,再充入与原来等量的的N2和H2,重新达到平衡后,N2的转化率。
分析如下:
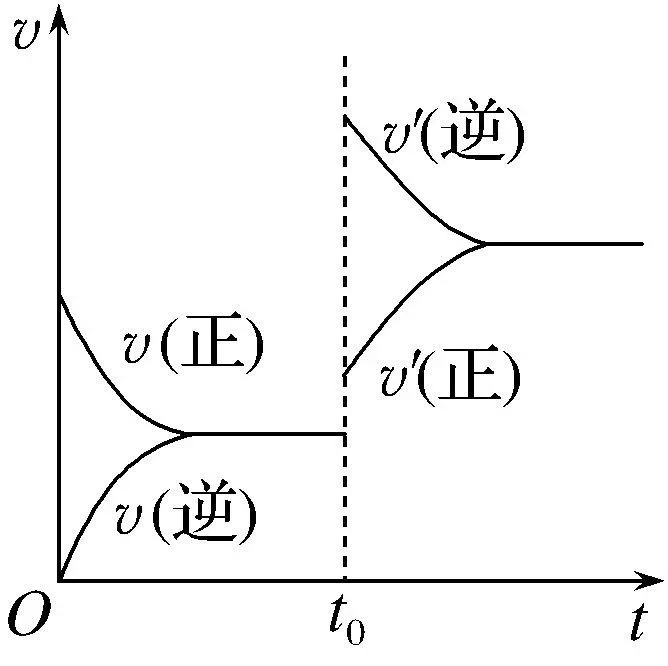
①和②是等效平衡,在①和②中N2的转化率相同。
②到③是增大压强,平衡正向移动。③中N2的转化率比②的高。
①到③就是再充入等量的反应物,与增大压强的效果相同。
所以结果是,N2的转化率提高。
结论是,充气问题等效于增大压强。
但注意的是,如果在体系中只充入N2或H2,则不是充气问题。必须是以原来的比例充入对应的物质。
【练习】
1、在2L 密闭容器中发生反应,2SO2+O2⇌2SO3,若12min内SO2的物质的量从7mol 降到4.6mol,求这段时间内N2的平均反应速率。
2、书写下列化学方程式:
(1)草酸(H2C2O4)与含稀H2SO4的酸性KMnO4反应。
(2)Na2S2O3与稀H2SO4反应。
(3)KI与稀H2SO4的混合后,放在空气中慢慢反应。
3、画出草酸(H2C2O4)与酸性KMnO4反应的速率图像。
4、在2L 体积不变的密闭容器中发生反应,2SO2+O2⇌2SO3,若开始时SO2和O2的物质的量分别为4mol,5mol,此时的压强为18MPa,达到平衡时,SO2反应掉了2mol,求①达到平衡时SO2的体积分数,②O2的转化率,③反应后的体系压强,④O2的分压,⑤混合气体的平均相对分子质量,⑥混合气体的密度,⑦Kc,⑧Kp。
5、在密闭容器中发生反应,2SO2+O2⇌2SO3ΔH<0,达到平衡。
(1)升高温度,平衡向移动。
(2)减小压强,平衡向移动。
(3)减少SO3,平衡向移动。
(4)加入催化剂,平衡向移动。
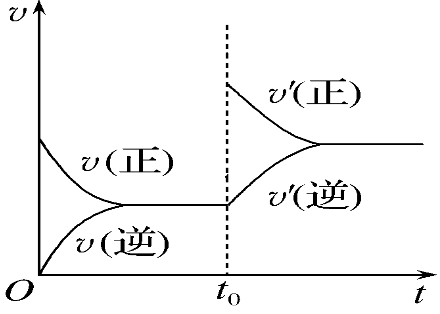
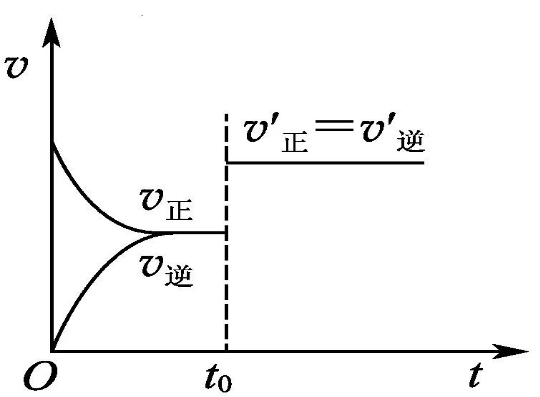
(5)下图在t0时刻改变条件后,反应速率变化如图所示。改变的条件是。
6、(1)酸性K2Cr2O7溶液显色。加碱变为碱性后,Cr2O72-会变为 ,溶液显 色。
(2)NO2降温后,气体的颜色会。标准状况下的22.4L 二氧化氮气体中,n的物质的量 1mol(填>、=、<)。
7、(1)当一个反应的ΔH<0、ΔS<0时,此反应的自发可能性为 。
(2)若一个反应的ΔH=+53kJ/mol、ΔS=+112J/(mol·K),此反应在温度为 K时自发。
8、(1)等温等体积体系中2SO2+O2⇌2SO3,初始加入SO2和O2的物质的量分别为4mol,5mol。下列等温等体积体系和它是等效平衡体系的是 。
①4mol SO3,②4mol SO3、3mol O2,③2mol SO2、4mol O2、2mol SO3,④1mol SO2、2mol O2、3mol SO3。
(2)恒温恒容体系中2N2O5(g)⇌2NO2+O2,加入N2O5达到平衡,N2O5的转化率为a。再加入一定量的N2O5,达到平衡,N2O5的转化率为b。问a和b谁大?
【练习答案】
1、0.1 mol/(L·min)
2、(1)5H2C2O4+2KMnO4+3H2SO4=10CO2↑+K2SO4+2MnSO4+8H2O。
(2)Na2S2O3+H2SO4=Na2SO4+S+SO2↑+H2O。
(3)4KI+ O2+2H2SO4=K2SO4+2I2+2H2O。
3、
4、①25%,②20%,③16MPa,④8MPa,⑤52,⑥208g/L,⑦1/2(mol/L)-1,⑧1/8(MPa)-1。
5、(1)逆向,(2)逆向,(3)正向,(4)不移动,(5)减少SO2或O2的量。
6、(1)橙色。CrO42-,黄。(2)变淡,>。
7、(1)低温自发。(2)473·21。
8、(1)②③,(2)a大。

- 全部评论(0)
