第十讲:化学反应与热能
时间:2021-04-21 09:45 来源:高中化学教学研究 作者:张德金 点击: 次 所属专题: 化学反应与热能
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
化学反应与能量的关系在高中化学中是比较简单的一部分,但关于它的研究,社会意义重大。当今社会还是以化学能源为主,如果能轻松实现将植物的秸秆转化为汽油,价值将是不可估量的,目前没人做到。电化学虽然和能量有关,但在高中阶段主要考虑的是电极反应,所以不放在这儿研究。
学习化学反应与能量,主要学习化学反应为什么会吸收或放出能量,什么是焓变,如何用热化学反应方程式表达化学反应与能量的关系,几种特殊的反应热,一种重要的热化学反应规律——盖斯定律。
1、化学反应为什么会吸收或放出能量
有两种解释方式,一种是断键成键方式,一种是总能量方式。
(1)断键成键方式
当物质发生化学反应时,先要断开一部分旧的化学键(包括分子间作用力),然后再形成一部分新的化学键。反应物在断开化学键时要吸收能量,而形成生成物中的化学键要放出能量。化学键的断裂和形成正是化学反应中能量变化的主要原因。
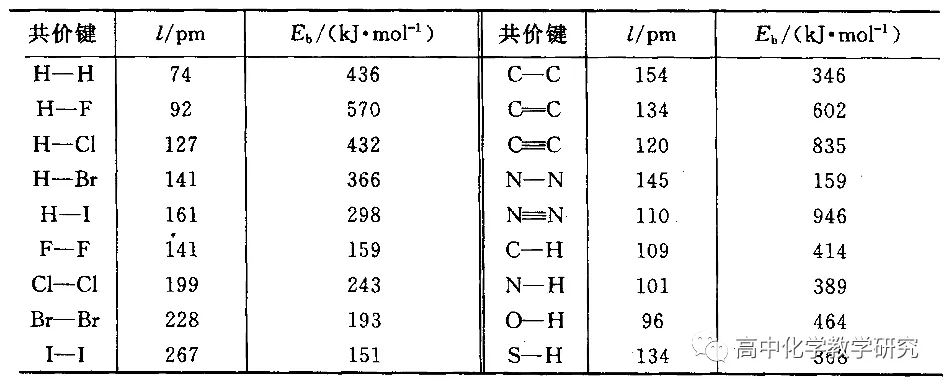
键能表
例如:1mol H2和1mol Cl2反应生成2mol HCl。
将1mol H2断键成为2mol H需要吸收436kJ能量,将1mol Cl2断键成为2mol Cl需要吸收243kJ能量,再将2mol H和2mol Cl形成2 mol HCl需要放出432×2=864kJ能量。所以1mol H2和1mol Cl2反应生成2mol HCl最后放出185kJ的能量。
需要注意的是,很多反应的化学键的断裂和形成要更复杂。宏观物质的反应,既有化学键的变化,也有分子间作用力的变化。在键的断裂数量上,很多反应只有部分键的断裂和形成。
(2)总能量方式
任何物质都含有一定的内能。所有的反应物会有一定的总能量,所有的生成物也有一定的总能量。
当反应物的总能量高于生成物的总能量时,反应放出能量。
当反应物的总能量低于生成物的总能量时,反应吸收能量。
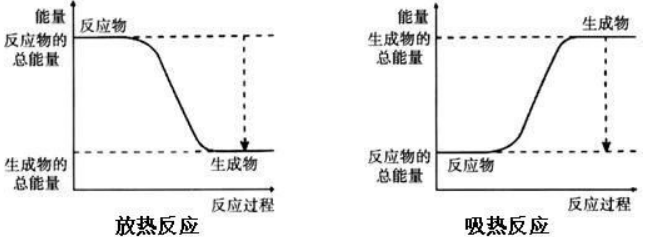
反应物的总能量与生成物的总能量的差量,就是这个反应吸收或放出的能量。
2、什么是焓,什么是焓变
焓(H)是与物质的内能有关的物理量,可以看作物质含有的能量。每种物质都有一定的焓(能量)。
在一个化学反应中,反应物有一定的焓,生成物也有一定的焓。当反应物经过反应变为生成物时,焓有了变化。这种变化就叫焓变,符号为ΔH,单位是kJ/mol。
规定:ΔH为“-”或ΔH<0,是放热反应。
ΔH为“+”或ΔH<0,是吸热反应。
若用断键成键方式,若断键吸收能量为Q吸,成键放出能量为Q放。
ΔH的计算式为:ΔH =Q吸-Q放
若用总能量方式,若反应物总能量为H反应物,成键放出能量为H生成物。
ΔH的计算式为:ΔH =H生成物-H反应物
这两个计算式需要思考和琢磨,最好自己用上面的规定和生活经验推理出来,用体验式学习学会。
3、如何用热化学反应方程式表示化学反应与能量的关系
如果用反应方程式来表示化学反应与能量之间的关系,就得带上能量的表示,而能量的多少不仅和物质的量有关,还和物质的状态、反应的环境(温度和压强)有关。
表示化学反应与能量之间的关系的化学方程式,就是热化学方程式。在热化学方程式中,系数带有物质的量的含义,有温度和压强,有物质的状态,还有能量表示,这就是热化学方程式的几个特殊要素。
H2(g)+I2(g)=200℃101KPa=2HI(g)ΔH =-14.9kJ/mol
这个热化学方程式的含义是,1mol H2气体和1mol I2气体在200℃和101KPa的条件下,完全生成2mol HI气体时,放出14.9kJ的能量。
对于热化学方程式注意以下几个问题:
(1)若没表示反应条件,指的是常温常压,温度为25℃(273.15K)和大气压强为101.325KPa(1标准大气压,760毫米汞柱)。
(2)若为可逆反应,并不是指反应达到平衡状态时的能量变化,而是指反应物完全转化为生成物的能量变化。
如N2(g)+2H2(g)⇌2NH3(g)ΔH =-92.4kJ/mol
不是指1mol N2气体和3mol H2气体在密闭体系中达到平衡时放出的能量。而是指1mol N2气体和3mol H2气体在常温常压下完全变成2mol NH3气体时放出的能量。
(3)除了温度、压强、状态符号、能量、浓度之外,关于化学方程式的其它一些符号不再写入。如高温、Δ、燃烧、电解、催化剂等反应条件符号和↓、↑等现象符号。
(4)关于对热化学方程式的理解,还有一种重要的思维变化是,热化学方程式可以只表示左边的物质和右边的物质之间的能量的差值,而不意味着反应能发生。这在盖斯定律中很重要。
4、几种特殊的反应热
在陈述这些特殊的反应热时,如果在默认下大家都已经知道这种反应热是放热还是吸热,或者在陈述语言中带上了“放出”或“吸收”的词语,那么就可以采用绝对值的方式陈述。否则就要带上“+”“-”陈述。
如NaCl的结晶热为ΔH =-a kJ/mol,因为多数人都不知道NaCl结晶是吸热还是放热。
醋酸电离时,吸收的电离热为BkJ/mol,因为陈述中已经提到了吸收能量。
CH4的燃烧热为CkJ/mol,因为大家都知道燃烧肯定放热。
(1)燃烧热:是指常温常压下1 mol 纯物质完全燃烧生成稳定的化合物时所放出的热量。
注意:是否是纯净的物质,在常温常压下每一种物质的状态,是否是完全燃烧,产物是否是稳定的化合物。
①2c(s)+O2(g)=2CO(g)ΔH1
②CH4(g)+ O2(g)=CO2(g)+2H2(g)ΔH2
③CH4(g)+ 2O2(g)=CO2(g)+2H2O(g)ΔH3
④2S(s)+3O2(g)=2SO3(g)ΔH4
这些ΔH都不是指燃烧热。①的CO不是完全燃烧的生成物,②的H2不是完全燃烧的生成物,③H2O不是液态,不符合常温的反应条件。④SO3不能由S直接燃烧生成。
(2)中和热:常温常压下酸的稀溶液和碱的稀溶液中和生成1mol 水时放出的热量。
H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3kJ/mol
ΔH=-57.3kJ/mol是指强酸与强碱的中和热。并且,在反应过程中除了中和反应,不能有别的反应存在。
弱酸、弱碱在反应时,因为有电离的影响,中和热不是-57.3kJ/mol。
(3)溶解热:指常温常压下1mol 溶质溶解在大体积的水中时所放出或吸收的热量。
有些物质溶解时会放热,如NaOH、浓H2SO4。有些会吸热,例如NH4NO3、NH4Cl。
5、一种重要但不高深的热化学反应规律——盖斯定律
因为热化学方程式表示的是反应物总能量和生成物总能量的差值,在环境相同的不同热化学方程式中等量的同种物质的能量相同。
如果知道几个反应的热化学方程式,通过数学计算,就能计算出新的热化学方程式。
比如,利用C(s)+O2(g)=CO2(g)ΔH=-393.5kJ/mol
CO(g) +1/2O2(g) = CO2(g) ΔH=-283.0kJ/mol
进行方程式的左边和左边相减,右边和右边相减,就能得到:
C(s)+ 1/2O2(g)=CO(g) =-110.5kJ/mol
而这就是利用盖斯定律进行求解新的热化学方程式。
盖斯定律的内容是:化学反应不管一步完成,还是多步完成,反应热相同。也就是,化学反应的反应热只和反应的始态和终态有关,和反应的途径无关。
如图,ΔH=ΔH1+ΔH2=ΔH3+ΔH4+ΔH5
它的意义是可以用能测定的热化学方程式,求解不能测定的热化学方程式。它的应用价值在于可以通过计算来判断一个反应的热效应,从而在工业设计时,指导能源的寻找、利用和再生等。
6、一次能源,二次能源,可再生能源,非再生能源,新能源
(1)一次能源,指在自然界存在的能源,如煤炭、石油、天然气、水能、太阳能、风能、潮汐能、生物质能等。
二次能源指由一次能源加工转换而成的能源产品,如电力、焦炭、煤气、沼气、蒸汽、热水和汽油、煤油、柴油、重油等石油制品等。
注意:电能被利用后,经由电风扇,再转化成风能,这时风能也是二次能源。
在火电厂燃料燃烧之后先变成蒸汽热能,蒸汽再去推动汽轮机变成机械能,汽轮机又带动发电机转换成电能,一共转换了三次,仍叫二次能源。
(2)一次能源又可分为可再生能源和非再生能源。
可再生能源是指可以不断得到补充或能在较短周期内再产生的能源。如风能、水能、海洋能、潮汐能、太阳能和生物质能等。
非再生能源,指短期内无法恢复的能源。如煤炭、石油、天然气、油页岩等。
(3)新能源是指在新技术基础上加以开发利用的可再生能源,包括风能、太阳能、生物质能、地热能、氢能、海洋能、潮汐能、核能等。
常规能源指已经广泛利用的能源,如煤炭、石油、天然气、水能等。
7、常见的放热反应和吸热反应
需要持续加热的,高温的,只能靠电解才能发生的,一般是吸热反应。
(1)放热反应:
燃烧反应,金属与酸的反应,活泼金属与水的反应,大多数的化合反应,酸碱中和的反应,铝热反应,爆炸反应。
(2)吸热反应:
大多数的分解反应,C、CO、H2还原金属氧化物,带八个结晶水的氢氧化钡与氯化铵反应,大多数盐的水解反应。
8、盖斯定律的计算技巧:
例一
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1=-870.3kJ/mol
②C(s)+O2(g)=CO2(g) ΔH2=-393.5kJ/mol
③H2(g)+1/2O2(g)=H2O(l) ΔH3=-285.8kJ/mol
则:2C(s)+O2(g)+2 H2(g)=CH3COOH(l) ΔH= 。
(1)找到目标方程式中只在上面的一个方程式中出现的物质:C、H2、CH3COOH。O2不是,它在上面三个方程中都有。
(2)若与原方程式的物质在同侧,则对原方程式相加。异侧,则相减。若系数不同,则对整个方程式扩大或缩小倍数:②×2+③×2-①,整理后就会得到目标方程式。
(3)反应热也以上面的倍数相加减,就得到目标方程式的反应热。ΔH=-488.3kJ/mol。
例二
①3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH=-47 kJ/mol
②Fe3O4(s)+CO(g) =3FeO(s)+CO2(g) ΔH= +19 kJ/mol
③FeO(s)+CO(g) =Fe(s)+CO2(g) ΔH=-11 kJ/mol
则:Fe2O3(s)+3CO(g) =2Fe(s)+3CO2(g) ΔH= 。
(4)若用上面的(1)、(2)处理后没有得到目标方程式,则将处理后的方程式再与其它剩余的方程式进行同样的处理,直到得到目标方程式为止。
①×(1/3) +③×2得:
Fe2O3(s)+ 2FeO(s)+7/3CO(g)= 2Fe(s)+2/3Fe3O4(s)+7/3CO2(g) ΔH=-113/3 kJ/mol
再将②×2/3加上得:
Fe2O3(s) +3CO(g)= 2Fe(s)+3CO2(g) ΔH=-25 kJ/mol
【练习】
1、若一个反应断键吸收的能量为Q吸,成键放出的能量为Q放。
ΔH的计算式为:ΔH = 。
若一个反应的反应物总能量为H反应物,成键放出能量为H生成物。
ΔH的计算式为:ΔH = 。
2、(1)氢气的燃烧热为285.8kJ/mol,写出氢气燃烧的热化学方程式。
(2)硫粉的燃烧热为296kJ/mol,写出硫燃烧的热化学方程式。
(3)稀醋酸与稀Ba(OH)2反应的中和热为43 kJ/mol,写出稀醋酸与稀Ba(OH)2反应的热化学方程式。
3、(1)下列属于一次能源的是,二次能源的是 。
①石油、②风能、③太阳能、④电力 ⑤生物质能、⑥焦炭、⑦氢能、⑧汽油
(2)下列属于可再生能源的是,非再生能源的是 。
①石油、②风能、③太阳能、④水能、⑤生物质能、⑥煤炭
(3)下列属于新能源的是,常规能源的是 。
①天然气、②海洋能、③水能、④风能 ⑤核能、⑥生物质能、⑦氢能、⑧煤炭
4、(1)已知:①2CO(g)+O2(g)=2CO2(g) ΔH=-566kJ/mol
②2H2(g)+O2(g)=2H2O(g)ΔH=-484kJ/mol
③CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890kJ/mol
则:CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=_____。
(2)已知:①N2(g)+O2(g)= 2NO(g) ΔH =akJ/mol
②N2(g)+3H2(g)=2NH3(g)ΔH2=b kJ/mol
③2H2(g)+O2(g)=2H2O(g)ΔH= c kJ/mol
则:4NH3(g)+4NO(g) +O2(g)= 4N2(g)+6H2O(g) ΔH= 。
【练习答案】
1、Q吸-Q放、H生成物-H反应物
2、(1)H2(g)+1/2O2(g)=H2O(l)ΔH= -285.8kJ/mol
(2)S(s)+ O2(g)=SO2(g)ΔH= -296kJ/mol
(3)CH3COOH(aq)+1/2Ba(OH)2(aq) =1/2(CH3COO)2Ba(aq)+ H2O(l)ΔH= -43 kJ/mol
3、(1)①②③⑤、④⑥⑦⑧
(2)②③④⑤、①⑥
(3)②③④⑤⑥⑦、①⑧
4、(1)+160kJ/mol
(2)(3c-2a-2b)kJ/mol

- 全部评论(0)
