金属性与金属活动性一样吗?
时间:2021-07-08 16:05 来源:追寻化学教育的本源 作者:苑凌云 点击: 次 所属专题: 金属性 金属活动性
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
金属性是对元素而言的,是指元素的气态原子失去电子变成气态阳离子倾向的大小,是元素原子的性质,定量判断标准是电离能(符号:I,单位:kJ/mol)。
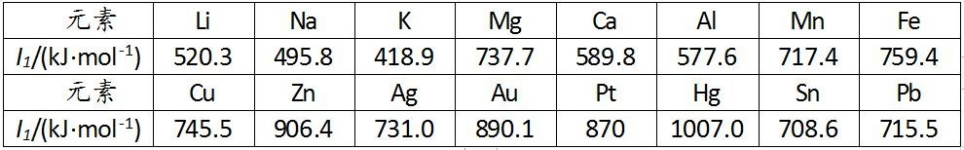
常见金属元素的第一电离能 I1
第一电离能越小,元素的原子越易失去电子,该元素的金属性越强。金属性强弱的其它判据:
1、金属元素最高价氧化物对应的水化物的碱性强弱;
2、金属与水或酸反应置换出氢气的难易程度;
3、置换反应。
金属活动性(活泼性)是对单质而言的,指的是金属单质在水溶液中的性质。
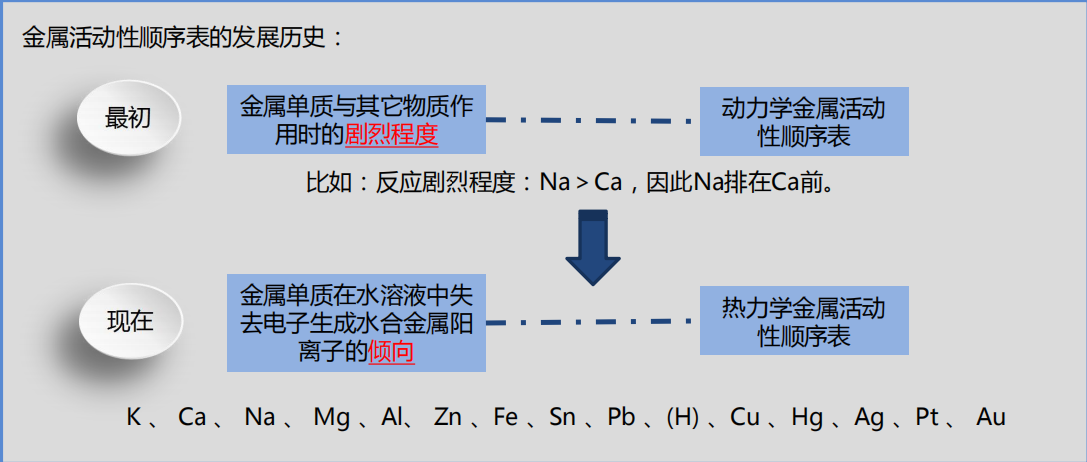
从热力学角度来看,金属单质M在水溶液中变成水合阳离子Mn+(aq)的过程如下:
氢气所处环境不同,其性质也会发生变化: (我们把此处铂吸附了的活性氢暂记成H2*) 如:H2*可以从硫酸铜溶液中置换出金属铜,普通氢气则不能; H2*可以同氧气迅速化合,普通氢气不可以。
为什么H2*和普通氢气性质不同呢?
以“ H2*可以从硫酸铜溶液中置换出金属铜,普通氢气不能”为例: 实际上,将普通H2通入含有Cu2+的溶液中,Cu2++H2==2H++Cu的氧化还原反应在热力 学上是可行的。但是,反应是否真的发生或者说能否观察到明显现象不仅取决于热力学是 否自发,还取决于动力学能垒能否克服,即反应速率是否足够大。 从动力学来看,标准氢电极上的铂黑电极不仅仅作为电极,同时还是氢分子分解成活性较高的活性氢原子的催化剂。
热力学角度:钙与水反应比钠与水反应的趋势更大; 动力学角度:钠与水反应比钙与水反应更剧烈。其原因:
钠的熔点为97.8 ℃,钠与水反应放出的热量可使钠熔化,增大了钠与水的接触面积;钙的熔点为845 ℃,在水中Ca与水反应生成的Ca(OH)2为微溶物,会附着在Ca的表面,阻碍Ca 和水的接触,使反应难以进行,所以Na与水的反应更剧烈。
类似的,金属活动顺序表中Al排在Fe前,但二者与酸的反应速率却是Fe更快,这是因为 Al表面通常会生成一层致密的氧化膜阻碍其与酸的反应。
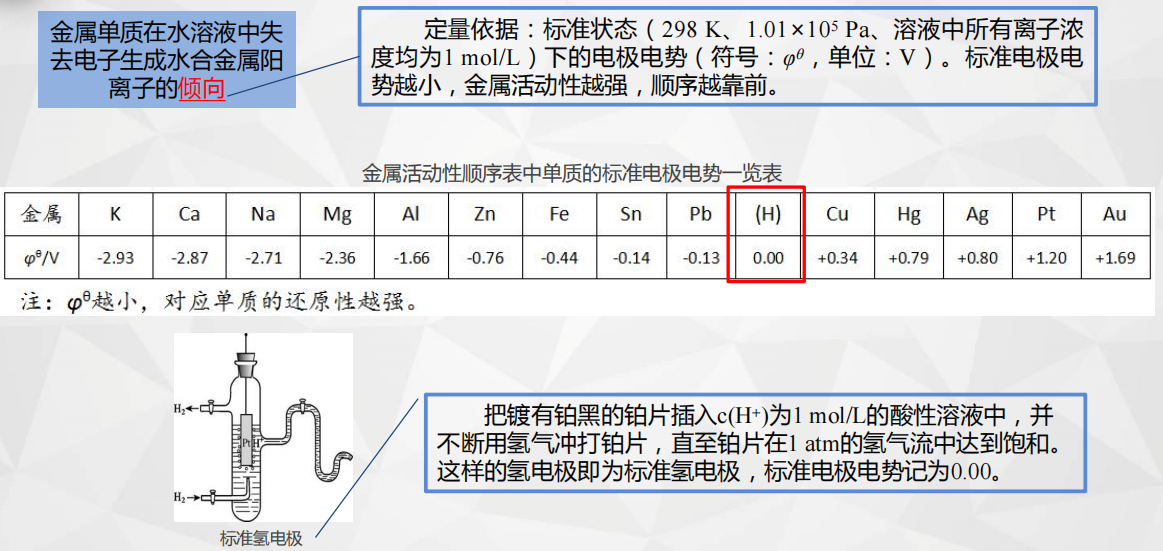
金属的标准电极电势是在水溶液中测定的,因此,以其为标准的金属活动性顺序一般只适用于水溶液体系中金属单质与其他金属阳离子(或H+)之间能否发生置换反应的判断,不适用于高温和干态。
例如: 工业上制备金属K:KCl(l)+Na(l)==NaCl(l)+K(g),熵增驱动反应,不能套用金属活动顺序表的规律来进行解释
另外,即使是在水溶液体系中金属单质与其他金属阳离子(或H+)之间的置换反应, 也有一些特例存在。
例如:金属活动性顺序中,Sn排在Pb的前面, 但Pb在3 mol/L 的Sn2+溶液中,可以发生反应:Pb+Sn2+==Sn+Pb2+,这是因为在标准状态下,φθ(Sn2+/Sn) =-0.1364 V,φθ(Pb2+/Pb) =-0.1263 V,二者的标准电极电势极为接近,当Sn2+的起始浓度为3 mol/L 时,不再是标准状态,此时电极电势发生改变, 导致铅可以把锡置换出来。

- 全部评论(0)
