什么是活化能?
时间:2021-07-08 16:10 来源:追寻化学教育的本源 作者:苑凌云 点击: 次 所属专题: 活化能
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1889年,瑞典化学家阿伦尼乌斯最早提出了活化能的概念。阿伦尼乌斯将普通分子转化为活化分子所需吸收的最低能量称为活化能(Ea)。
在现行无机化学教材中,对于活化能的描述主要有3种观点:
①普通分子转变为活化分子所需要的能量;
②活化分子的平均能量与反应物分子的平均能量之差;
③活化分子所具有的最低能量与反应物分子的平均能量之差。
当下较为广泛接受第2种观点。科学家塔尔曼应用量子力学和统计力学原理推导证明:
活化能是活化分子(能发生有效碰撞的分子)与普通分子(即反应 物分子)所具能量的平均值之差。
基元反应活化能:
①基元反应的活化能Ea是指活化分子平均能量与普通分子平均能量的差值。无论是活化分子还是普通分子,各自的分子能量呈现出一种统计分布规律,各种分子能量有高有低。处于低能级上的普通分子需吸收大于Ea的能量才能成为活化分子,而处在高能级上的普通分子只需吸收小于Ea的能量就能活化,因此Ea是个平均值。
②所有反应速率的碰撞理论或过渡态理论,都是基元反应速率理论,在总反应层次上的任何应用都是不恰当的。
③基元反应的活化能有简单而清晰的物理含义,一般都是正值(存在基元反应的活化能Ea≤ 0)。
总反应活化能:
实验研究表明,总反应活化能只是若干基元反应活化能的某种数学关系综合的结果,已失去了清晰的物理含义,仅是一表观量,称为表观活化能,也叫总反应活化能或实验活化能。其值为决速步的最高能量与反应物初始能量的差值。
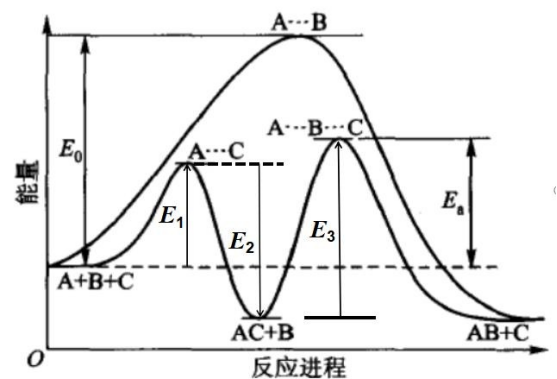
未使用催化剂时:基元反应的活化能=总反应的活化能=E0;
使用催化剂后:第一步反应的活化能为E1,第二步反应的活化能为E3, 总反应的表观活化能=Ea=E1+E3-E2。
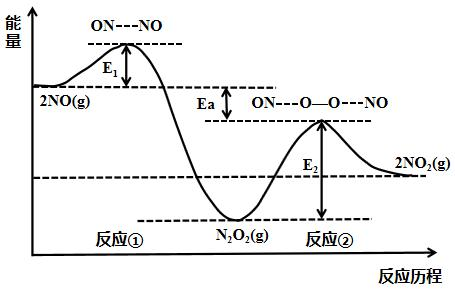
例如:对于反应:2NO(g)+O2(g) ⇌ 2NO2(g),实际由2个基元反应构成:
反应①:2NO(g) ⇌ N2O2(g);
反应②:N2O2(g)+O2(g) ⇌ 2NO2(g)。
此反应的表观活化能(-EakJ/mol)是一负值。表观活化能为负值的反应通常表现为温度升高,反应速率反而降低,原因有二:
①对于反应2NO(g)+O2(g)⇌ 2NO2(g),反应②是决速步骤。升高温度,反应②速率加快;同时,升高温度,反应①平衡逆向移动,使N2O2浓度减小,反应②反应物浓度减小,速率变慢。(主导因素)
②温度升高,催化剂失去活性,使反应速率下降。

- 全部评论(0)
(2958214281) 评论 href="/plus/view.php?aid=19891">什么是活化能?:好,太好了
