如何理解反应热与焓变的单位?
时间:2021-09-13 14:41 来源:未知 作者:化学自习室 点击: 次 所属专题: 焓变 反应热 反应进度
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
在依据化学课程标准编写的中学化学教材中,通常都会有下列热化学方程式:
2H2(g) + O2(g) =2H2O(1) ΔH =-571. 1kJ • mol-1
H2(g)++O2(g)= H2O(1) ΔH =-285. 8 kJ • mol-1
在化学教学中,学生们常常会产生下列困惑:在热化学方程式中,ΔH的单位是 kJ • mol-1,是指1 mol 物质参与反应,还是指生成1 mol 物质所产生的热效应?如何理解的单位?要解决这一问题,首先必须了解反应进度的概念。
对于任一化学反应:aA(g)+bB(g)=gC(g)+hD(g)
a、b、g、h分别为反应物和生成物的化学计量数,设ξ表示反应的进度,在反应开始时(t = 0,t为反应时间),反应进度为零,记作ξ=0,各物质的物质的量分别为叫n0(A)、n0(B)、n0(C)、n0(D),当反应进行到某一状态时,体系的反应进度为ξ时,各物质的物质的量分别为nξ(A)、nξ(B)、nξ(C)、nξ(D),则反应进度ξ定义为
![]()
例如,对于反应
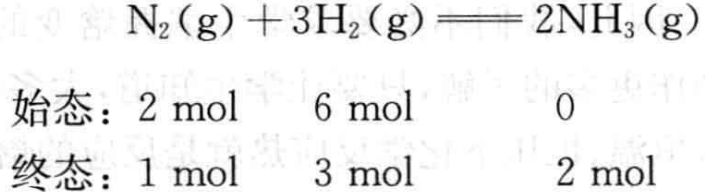
反应进度ξ可以表示为:
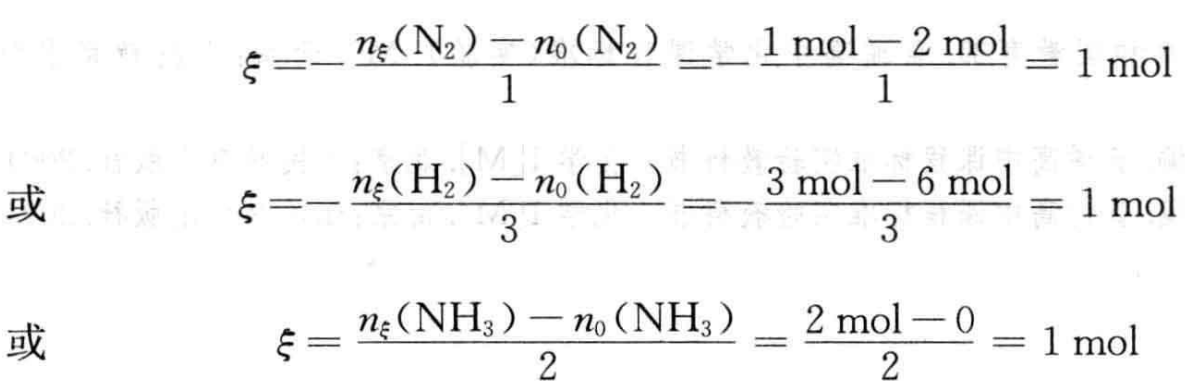
而对于反应:
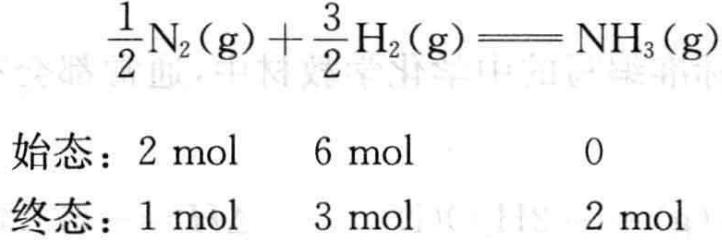
反应进度ξ可以表示为:
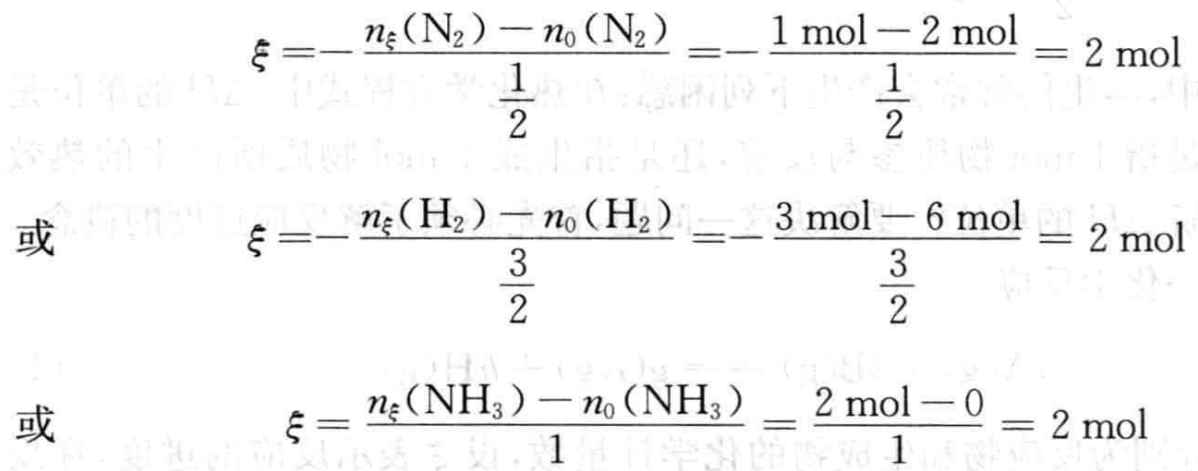
从上述例子中可以看出,反应(2)、(3)都是合成氨反应,反应的始态和终态也都是相同的,所不同的是化学方程式中各物质的计量数,因而反应进度ξ也不相同。化学反应进度有如下规律:
•反应进度ξ表示反应进行的程度;
•对于任一化学反应,按给定化学方程式中各物质的化学计量数之比反应时,在反应任意时刻,用任一组分来表示反应进度,其ξ值相等;
•反应进度ξ与方程式书写有关系;
•化学反应按化学计量数之比进行一个单位时,反应进度ξ就等于1 mol。
热化学方程式中的焓变ΔH与反应进度ξ是有关系的。
例如,2H2(g) + O2(g) ==2H2O(g) ΔH =-483.6 kJ • mol-1
是指2 mol H2(g)与1 mol O2(g)完全反应,生成2 mol H2O(g)(此时反应进度 ξ=1 mol)时的焓变。
而H2(g) +1/2O2(g) = H2O(g) ΔH =-241. 8 kJ • mol-1
是指1 mol H2(g)与+mol O2(g)完全反应,生成1 mol H2O(g)(此时反应进度也为ξ=1 mol)时的焓变。
可见,中学化学课程中热化学方程式中的ΔH,从本质上说是指按所给化 学方程式的化学计量数之比进行ξ= 1 mol 的反应的焓变,这就不难理解热化学方程式中的单位是kJ • mol-1了。
参考文献
[1]黄文平.化学反应进度F [J].咸宁学院学报,2005(6)
[2]李文方,孙宏民.热化学方程式中mol-1的含义[J].中学化学教学参考,2003(4)

- 全部评论(0)
