反应热的定律—盖斯定律及应用
时间:2023-08-11 16:51 来源:未知 作者:化学自习室 点击: 次 所属专题: 盖斯定律
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
化学反应中的反应热,无论该反应是一步完成还是分几步完成,总热效应相同。——盖斯定律
在讲盖斯定律的故事之前,先搞清楚反应热的概念,通常是指:当一个化学反应在恒压以及不作非膨胀功的情况下发生后,若使生成物的温度回到反应物的起始温度,这时体系所放出或吸收的热量称为反应热。也就是说,反应热通常是指:体系在等温、等压过程中发生物理或化学的变化时所放出或吸收的热量。用ΔH表示,单位:kJ∕mol(千焦耳/摩尔)。
例如,一氧化碳与氧气反应生成二氧化碳时放出大量的热,体系的温度也随之升高,但反应热是指定在某个相同温度(通常指定298.15K,即25℃)时反应过程的热效应。不同温度下,同一反应(包括反应物和生成物的聚集状态都相同)的热效应都是不同的。为了便于比较,通常要转换成标准状态下的数据。
化学反应的热效应很早就为化学家所注意,化学家希望通过测量反应热求出化学亲和力的量度。近代化学大牛拉瓦锡曾专门研究过反应热的问题,他和拉普拉斯是测定化学反应热的开创者。他们设计了一个简单的冰量热计,以被融化的冰的重量来计算反应热。他们证明,某一化学反应所放出的热量等于其逆反应所吸收的热量。
他们测定了炭的反应热为“1盎司炭燃烧可融化6镑2盎司的0℃的冰”,相当于-413.59 kJ∕mol,与现在的精确值-393.51 kJ∕mol非常接近,可见其工作相当出色。他们还测定了一些物质的比热,然而正如上面所说,拉瓦锡抛弃了燃素,却倾向于热质说,将“热”当成是一种元素,这多少限制了他对反应热的深入研究。
对化学反应热的研究作出了重大贡献的是盖斯(又译为黑斯)。盖尔曼·依万诺维奇·盖斯,1802年出生于今天瑞士的日内瓦,瑞士联邦成立于1803年,盖斯出生时日内瓦属于法国,直到1815年日内瓦才成为瑞士联邦的一个州。他的父亲是一位画家,在盖斯3岁的时候,被聘为莫斯科一个富有家族的家庭教师,于是全家迁居俄国,盖斯接受的是俄国教育。因此,盖斯应该算是俄国化学家。

盖斯
盖斯原来是学医的,1825年,他在俄国多尔帕特大学完成了“关于俄罗斯矿泉水的化学成分和医疗作用的研究”获得了医学博士学位,尔后前往当时欧洲的矿物化学与无机化学研究中心之一—瑞典斯德哥尔摩的化学大牛贝采里乌斯的实验室(其实就是一间大厨房,不过“麻雀虽小五脏俱全”,这里测出的原子量至今令人赞叹)工作,虽然盖斯与贝采里乌斯相处的时间不长,但两人结下了深厚的师生情谊。
前面提到,贝采里乌斯擅长分析各种矿物,测定了两千多种矿物的化学成分,发现了铈、硒、钍、硅等元素。这对盖斯的科学生涯有很大影响,他的科学兴趣集中在矿物分析方面。贝采里乌斯的信中经常提到盖斯,说明他们一直保持密切的书信联系。
盖斯回俄国后参加了乌拉尔的地质考究活动,1826年至1828年期间,他分析了西伯利亚各地的矿泉水的化学组成,发现了水硼酸钙镁石、钙铬石、水钙矾铜矿和碲银矿4种矿物,最后一种又称为盖斯银矿,分析了天然气、树脂、蜡、蔗糖等有机物的组成。由于盖斯杰出的科学研究工作,特别是发现了有经济和军事价值的矿产,他在1828年当选为彼得堡俄国科学院院士助理,1834年晋升为院士。
1830年,盖斯定居彼得堡,专心从事化学研究和教学工作。除了继续保持对矿物分析的热情外,他还关心同时代的化学家的理论研究。他不同意老师贝采里乌斯用来解释化学亲和力的电化二元论。沿着拉瓦锡的道路,盖斯设想如果能够测定出一定比例的化学元素化合时产生的热量,就可以用来阐明化学亲和力。盖斯因此完成了一生最重要的贡献——盖斯定律。
从1830年起,盖斯改进了拉瓦锡和拉普拉斯的冰量热计,从而较为准确地测出了大量化学反应中的反应热,他的量热装置如下图,在实验时将手柄转动,使玻璃杯翻转,则实验反应物混合,实验前,可对整个实验装置进行比热校正。
1839年,盖斯发表《在多重比例反应中的放热效应》一文,指出通过热的测定可以检出硫酸形成的不同水合物。1840年,他再次发表论文,指出当硫酸连续地生成数种水合物或者在水溶液里生成硫酸胺(NH3)2SO4,无论一步进行还是分步进行,热效应总值总是相同的。
他总结出化学反应的总热量守恒定律:化学反应中的反应热,无论该反应是一步完成还是分几步完成,总热效应相同。
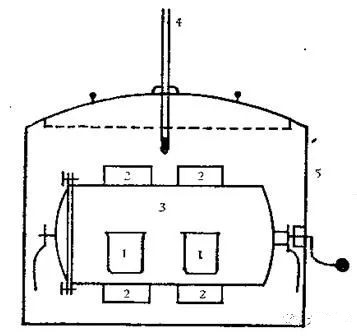
盖斯的量热装置:1.装有实验反应物的玻璃杯 2.铜制散热板 3.铜制圆罐 4.温度计 5.铅制外壳,内放7.5公升的水
盖斯还指出,盐酸(HCl)和钾碱(KOH)反应、盐酸和烧碱(NaOH)反应,两者的反应热相同。这一现象的本质迟至1887年阿累尼乌斯创立电离理论才得以揭示(实质均为H+和OH-反应,与K+、Cl-、Na+无关)。
1842年,盖斯还提出了第二个热化学方面的定律,即热中和定律,认为当中性盐在水溶液中发生复分解反应时,并不产生热效应。这种现象也是电离理论创立后才得以解释(实质是各种离子在水中共存,并没有形成沉淀或气体,离子间无反应,例如NaCl + KNO3=Na NO3+KCl )。
盖斯定律实质是热力学第一定律的一种具体的表述形式,尽管不很严格(因为等压热效应和等容热效应不一定相等),根据可测定的几个反应的热效应,利用盖斯定律即可计算一些很难直接用或尚未用实验方法测定的反应热效应。
这里举一个简单例子说明,在101.325kPa 和298.15K下,1molC(石墨)完全燃烧生成CO2 (g),可以有两种途径,如图 中的(1)及(2)+(3)。
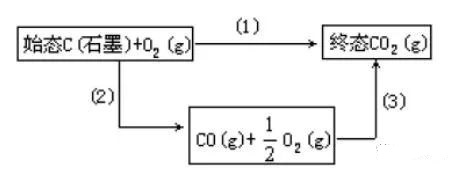
计算C(石墨) +1/2 O2 (g) = CO(g)反应热
途径(Ⅰ):一步反应,即反应(1),将1molC(石墨)直接完全燃烧成CO2 (g),C(石墨)+O2 (g) = CO2 (g),其反应热效应为QP,1 (298.15K)=-393.5 kJ∕mol (可测知)
途径(Ⅱ):分步反应,先假设1molC(石墨)不完全燃烧但均成为CO(g),C(石墨) +1/2 O2 (g) = CO(g), 即反应(2) ,其反应热效应为QP,2 (298.15K)(难以直接测知)
然后再由CO(g)完全燃烧成为CO2 (g),CO(g) + 1/2 O2 (g) = CO2 (g),即反应(3),其反应热效应为QP,3 (298.15K)=-283.0k kJ∕mol (可测知)
根据盖斯定律,可得:
QP,1 (298.15K)=QP,2 (298.15K)+QP,3 (298.15IK)
QP,2 (298.15K)=QP,1 (298.15K)-QP,3 (298.15K)
={(-393.5)-(-283.0)}kJ∕mol
=-110.5 kJ∕mol
上述计算表明,石墨不完全燃烧生成CO(g)时所放出的热量QP,2只有石墨完全燃烧生成CO2 (g)时所放出的热量QP,1 的1/4 多一些,从而可以理解使燃料完全燃烧的经济意义。
在反应中没有气态物质参加或生成(例如溶液中的酸碱中和反应),或者虽有气态物质参加或生成,但气体反应物的化学计量数之和等于气体生成物的化学计量数之和(例如石墨完全燃烧与O2 化合生成CO2 的反应)。此时系统的总体积及总压力一般可认为没有发生改变。
这就是说,反应可认为是在定容和定压的条件下进行的,反应的热效应既是等容热效应Qv,也是等压热效应QP。另一种情况较复杂,气体反应物的化学计量数之和不等于气体生成物的化学计量数之和。例如
CO(g) + 1/2 O2 (g) = CO2 (g)
或 CH4 (g)+2O2 (g) = CO2 (g)+2H2O(l)
如果反应是在弹式热量计内进行的,所测定的反应热效应为等容热效应Qv。如果反应是在敞口容器中(可认为是在通常大气压力的定压条件下)进行的,则反应热效应为等压热效应QP。前者系统没有体积的改变;而后者系统则有体积的改变。
在上例中,系统将向环境作压缩功或环境将向系统作膨胀功。膨胀功和压缩功可总称为体积功,在定压时可简单地以-P△V 表示之,△V指系统体积的改变。显然,此时反应的Qv与QP不会相等;另外,也表示反应发生时伴随的能量变化可有多种转换的形式,而不能仅藉热量的形式来解决,关于这些问题,这里是讲故事的,而不是教化学理论的,有兴趣的请自行参看普通化学教材。
盖斯定律发表后,热化学研究一直是处于冷宫状态,直到法国化学家贝特罗和丹麦化学家茹留·汤姆森设计了弹式热量计重新复活了反应热的研究。盖斯定律后来为世界各国化学教科书引用,则是奥斯特瓦尔德的功劳。这位诺贝尔化学奖得主生于俄国,早年在多尔帕特大学读书直到获得博士学位,并担任一段时间的讲师,因此他对盖斯的成就十分熟悉。1887年,他出版了《普通化学教程》一书,着重介绍了盖斯在热化学方面的成就。
盖斯对俄国化学的发展有很大贡献,他仿照拉瓦锡的化学命名法,建立了俄文的化学命名系统。在化学教育方面,他编写了著作《纯化学基础》,刊印达七版之多,成为当时俄国广泛使用的化学教科书,这是门捷列夫的《有机化学》和《化学原理》两本化学教科书出版以前的俄国标准化学教材。
他在教学中率先采用了独立的化学实验课的教学模式,盖斯的学生最有名的是沃斯科列森斯基,他是化学大牛门捷列夫的老师,盖斯还教过沙皇的亚历山大王子的化学。经盖斯等人的努力,原来名不见经传的彼得堡大学成为俄国远近闻名的一流大学。
1850年12月13日,盖斯卒于彼得堡,年仅48岁。他的过早地去世,无疑是俄国化学界和热化学研究上的损失。

- 全部评论(0)
