实验室制取氯气的问题集
时间:2021-10-29 10:53 来源:未知 作者:王笃年 点击: 次 所属专题: 氯气
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1、实验室制取Cl2时,氧化剂为什么选用需要加热的 MnO2而不选用不需要加热的KMnO4,K2Cr2O7等?
实验室里用到少量Cl2时,一般釆用氧化浓盐酸的方法制备。常用氧化剂有KMnO4,K2Cr2O7,MnO2 (需加热)、漂白粉(有效成分Ca(ClO)2),反应如下:
2KMnO4+16HCl = 2KCl + 2MnCl2+8H2O + 5Cl2↑ ;
K2Cr2O7+14HCl = 2KCl + 2CrCl3+7H2O + 3Cl2↑;
MnO2+4HCl(浓) MnCl2+2H2O+Cl2↑;
MnCl2+2H2O+Cl2↑;
Ca(ClO)2+4HCl=CaCl2+2H2O + 2Cl2↑.
上述所列氧化剂中,只有MnO2可以从自然界直接获得,它是软锰矿的主要成分,用MnO2氧化法制 Cl2是当年化学家舍勒最初发现的实验方法,至今一 般还沿用这种方法。强氧化剂氯酸钾也能与浓盐酸反 应产生Cl2,后来的研究发现,该反应过程中可能产生副产物ClO2,反应方程式为:2KClO3+4HCl = 2KCl+2H2O+Cl2↑ +2ClO2↑ , ClO2也是具有强氧化性的气体,会对Cl2的化学性质形成干扰.
2、既然制取Cl2的本质是氧化Cl-,还原剂为什么选用浓盐酸而不选用便宜的NaCl?
这与氧化还原反应发生的条件有密切关系,氧化 和还原虽然同时发生,但这2个过程却是分开的“半 反应”,氧化过程似乎很简单,2Cl--2e-=Cl2↑,但 还原过程就比较复杂了,比如MnO2中+4价锰得电 子变为Mn2+后,2个一2价氧变成什么?它会和溶液里的H+结合变为OH-或H2O,即MnO2+2e- + 4H+=Mn2++2H2O,显然,从还原反应的方程式看, 溶液中H+浓度越大(溶液的酸性越强),则反应越容易发生,MnO4-、Cr2O72-等氧化剂也发生类似的过程,有兴趣的同学可以独立深入研究一下。
换句话说,是因为MnO2、MnO4-、Cr2O72-等氧化剂在酸性条件下氧化性比在中性条件要强得多,氧化过程更容易发生且反应更快。具体可通过氧化剂、还原剂的电极电势计算进行判断,由于涉及的知识比较复杂,这里就不详细介绍了。
3、为什么用水(或饱和食盐水)除去HCl?排饱和食盐水法收集Cl2的原理何在?
氧化浓盐酸制取Cl2时,浓盐酸会挥发产生HCl、H2O等杂质.除去H2O比较容易,使用酸性干燥剂 (如浓硫酸)即可;除去HCl就难了,因为几乎一切能 与HCl发生反应的物质,都可以和Cl2发生反应。无奈之下,人们根据Cl2和HCl在水中溶解度差异较大这 一事实,设计了用少量水(或饱和食盐水)洗涤气体的 方法除去HCl,虽然Cl2也会有所溶解,但毕竟其溶解度小,溶解的量有限。
采用排空气法很难收集到纯净、不含有空气的 Cl2,有时为了需要,也可釆用排饱和食盐水的方法收集Cl2。之所以采用饱和食盐水,是因为与水相比,Cl2在饱和食盐水里的溶解度比在纯水里要小一些,食盐水降低Cl2溶解度,与化学平衡原理有关:
Cl2+H2O H++ Cl-+ HClO
H++ Cl-+ HClO
食盐水中有较高浓度的Cl-,可以抑制上述反应的发生,和水反应的Cl2的量减少,Cl2的溶解度自然随之减小。
4、洗气瓶能够除尽杂质气体吗?
要回答这个问题,首先要分析清楚气体洗涤的原理,以用浓硫酸洗涤Cl2(含有H2O蒸气杂质)为例, 如图1所示:
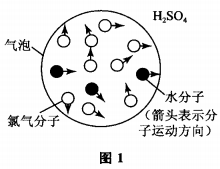
图中大球表示一个气泡,其中的小白球表示Cl2 分子,黑球表示杂质水分子,H2SO4对水分子的作用并不像磁铁吸引铁屑一样,距离较远即会吸引过去,所有气体分子(Cl2和H2O)在球内做无规则热运动, 只有当水分子运动到气泡的边缘直接接触到H2SO4 时,才可能与硫酸分子发生作用被硫酸分子“捕捉” 到,而从气泡内除去。这样,气泡在浓硫酸中上升的过程中,运动到气泡边缘的H2O即被H2SO4吸收,随着气泡的上升,其中水蒸气的含量逐渐减小,最终 H2O的含量降低到很低的比例,大部分被除去,而始终未到过气泡边缘的H2O是不可能被除去的。
通过以上分析可知,洗气法除去杂质的操作是不可能完全除掉所有杂质的,只要把杂质的比例降低到一定程度,我们就可以说杂质被除尽了。基于上述原理,若想尽可能地运用洗气法除去杂质气体,一是增加洗涤液用量,使气泡在其中停留时间尽可能长;二是使气泡尽可能小(比如使用细的导管),这样可以缩短杂质分子运动到气泡边缘的距离,增加杂质分子和洗涤液接触的机会。由于洗气法不能保证完全除去所有杂质气体分子,所以很多时候要在洗气瓶后增加装置,以检验(确认)杂质气体是否已经被除尽。

- 全部评论(0)
