原电池工作原理及其“盐桥”和“离子交换膜”在电池中的应用
时间:2021-11-23 14:22 来源:未知 作者:化学自习室 点击: 次 所属专题: 离子交换膜 盐桥 原电池工作原理
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、原电池
1、概念
通过氧化还原反应而产生电流的装置称为原电池,也可以说是把化学能转变成电能的装置。有的原电池可以构成可逆电池,有的原电池则不属于可逆电池。原电池放电时,负极发生氧化反应,正极发生还原反应。例如铜锌原电池又称丹聂尔电池,其正极是铜极,浸中硫酸铜溶液中;负极是锌板,浸在硫酸锌溶液中。两种电解质溶液用盐桥勾通,两极用导线相连就组成原电池。平时使用的干电池,是根据原电池原理制成的。
2、发现
原电池的发明历史可追溯到18世纪末期,当时意大利生物学家伽伐尼正在进行著名的青蛙实验,当用金属手术刀接触蛙腿时,发现蛙腿会抽搐。大名鼎鼎的伏特认为这是金属与蛙腿组织液(电解质溶液)之间产生的电流刺激造成的。1800年,伏特据此设计出了被称为伏打电堆的装置,锌为负极,银为正极,用盐水作电解质溶液。1836年,丹尼尔发明了世界上第一个实用电池,并用于早期铁路信号灯。
3、工作原理
原电池反应属于放热的反应,一般是氧化还原反应,但区别于一般的氧化还原反应的是,电子转移不是通过氧化剂和还原剂之间的有效碰撞完成的,而是还原剂在负极上失电子发生氧化反应,电子通过外电路输送到正极上,氧化剂在正极上得电子发生还原反应,从而完成还原剂和氧化剂之间电子的转移。两极之间溶液中离子的定向移动和外部导线中电子的定向移动构成了闭合回路,使两个电极反应不断进行,发生有序的电子转移过程,产生电流,实现化学能向电能的转化。
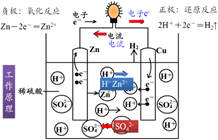
原电池工作原理
但是,需要注意,非氧化还原反应一样可以设计成原电池。从能量转化角度看,原电池是将化学能转化为电能的装置;从化学反应角度看,原电池的原理是氧化还原反应中的还原剂失去的电子经外接导线传递给氧化剂,使氧化还原反应分别在两个电极上进行。
4、形成条件
①电极材料由两种金属活泼性不同的金属或由金属与其他导电的材料(非金属或某些氧化物等)组成。
②电解质存在。
③两电极之间有导线连接,形成闭合回路。
④发生的反应是自发的氧化还原反应。
只要具备前三个条件就可构成原电池。而化学电源因为要求可以提供持续而稳定的电流,所以除了必须具备原电池的三个构成条件之外,还要求有自发进行的化学反应。也就是说,化学电源必须是原电池,但原电池不一定都能做化学电池。
形成前提:总反应为自发的化学反应。
常见电极
A.活泼性不同的金属:如锌铜原电池,锌作负极,铜作正极;
B.金属和非金属(非金属必须能导电):如锌锰干电池,锌作负极,石墨作正极;
C.金属与化合物如:铅蓄电池,铅板作负极,二氧化铅作正极;
D.惰性电极如:氢氧燃料电池,电极均为铂。
5、电极判断
负极:电子流出的一极(负极定义);化合价升高的一极;发生氧化反应的一极;活泼性相对较强(有时候也要考虑到电解质溶液对两极的影响)金属的一极。(仅适用于原电池)
正极:电子流入的一极(正极定义);化合价降低的一极;发生还原反应的一极;相对不活泼(有时候也要考虑到电解质溶液对两极的影响)的金属或其它导体的一极。(仅适用于原电池)
阳极:发生氧化反应的电极(阳极定义)
阴极:发生还原反应的电极(阴极定义)
在原电池中,外电路为电子导电,电解质溶液中为离子导电。
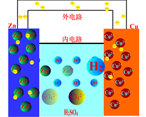
二、从盐桥使用重新认识氧化还原反应(化学反应)
电池的极化作用
原因主要是由于在铜极上很快就聚集了许多氢气泡,把铜极跟稀硫酸逐渐隔开,这样就增加了电池的内阻,使电流不能畅通。这种作用称为极化作用。由于是单液电池,因而不可能彻底将氧化反应与还原反应分开。氢离子依然可以在锌片上得到电子。
盐桥的使用突破了氧化剂、还原剂只有直接接触、相互作用才能发生电子转移的思维定式能使氧化反应与还原反应在不同的区域之间进行得以实现。为原电池持续、稳定地产生电流创造了必要的条件,也为原电池原理的实用性开发奠定了理论基础。
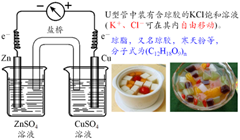
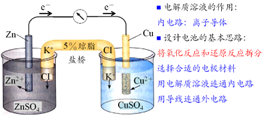
⑴盐桥的构成与原理:
盐桥里的物质一般是强电解质而且不与两池中电解质反应,教材中常使用装有饱和KCl琼脂溶胶的U形管,离子可以在其中自由移动,这样溶液是不致流出来的。
⑵用作盐桥的溶液需要满足以下条件:
阴阳离子的迁移速度相近;盐桥溶液的浓度要大;盐桥溶液不与溶液发生反应或不干扰测定。
⑶盐桥作用的基本原理是:
由于盐桥中电解质的浓度很高,两个新界面上的扩散作用主要来自盐桥,故两个新界面上产生的液接电位稳定。又由于盐桥中正负离子的迁移速度差不多相等,故两个新界面上产生的液接电位方向相反、数值几乎相等,从而使液接电位减至最小以至接近消除。
常用的盐桥溶液有:饱和氯化钾溶液、4.2mol/L KCl、0.1mol/L LiAc和0.1mol/L KNO3等。
⑷盐桥的作用:
盐桥起到了使整个装置构成通路、保持电中性的作用,又不使两边溶液混合。盐桥是怎样构成原电池中的电池通路的呢?
Zn棒失去电子成为Zn2+进入溶液中,使ZnsO4溶液中Zn2+过多,即正电荷增多,溶液带正电荷。Cu2+获得电子沉积为Cu,溶液中Cu2+过少,SO42-过多,即负电荷增多,溶液带负电荷。当溶液不能保持电中性,将阻止放电作用的继续进行。盐桥的存在,其中Cl-向ZnSO4溶液迁移,K+向CuSO4溶液迁移,分别中和过剩的电荷,使溶液保持电中性,反应可以继续进行。盐桥中离子的定向迁移构成了电流通路,盐桥既可沟通两方溶液,又能阻止反应物的直接接触。可使由它连接的两溶液保持电中性,否则锌盐溶液会由于锌溶解成为Zn2+而带上正电,铜盐溶液会由于铜的析出减少了Cu2+而带上了负电。
盐桥保障了电子通过外电路从锌到铜的不断转移,使锌的溶解和铜的析出过程得以继续进行。导线的作用是传递电子,沟通外电路。而盐桥的作用则是沟通内电路,保持电中性就是化学原电池的盐桥起到电荷“桥梁”的作用,保持两边的电荷平衡以防止两边因为电荷不平衡(一边失去电子,一边得到电子造成的)而阻碍氧化还原反应的进行。
三、离子交换膜
1、概念
离子交换膜是具有离子交换性能的,对溶液中的离子具有选择性透过能力的高分子薄膜。在应用时主要利用它的离子选择透过性,由于制膜的主要原料是离子交换树脂,故又称为离子交换(树脂)膜。
离子交换膜具有非常广泛的应用,它是分离装置、提纯装置以及电化学组件中的重要组成部分,在氯碱工业、水处理工业、重金属回收、湿法冶金以及电化学工业等领域都起到举足轻重的作用。
2、种类与功能
根据透过的微粒种类、功能和结构的不同,离子交换膜可以分为多种,在高考考查中常见的有阳离子交换膜、阴离子交换膜、质子交换膜和特殊离子交换膜等。
⑴质子交换膜只能让质子(H+)和水分子自由通过,其它离子和气体分子不能通过;
⑵阳离子交换膜可以让阳离子和水分子自由通过,而阴离子和气体分子不能通过;
⑶阴离子交换膜可以让阴离子和水分子自由通过,而阳离子和气体分子不能通过.
由于离子交换膜在化学工业,尤其在电化学工业中扮演着越来越重要的角色,在近年高考试题中也多次出现了联系工业生产实际,带离子交换膜的电化学装置。
3、离子交换膜在教材原理中的运用
⑴阳离子交换膜在氯碱工业中的应用
精制的饱和食盐水进入阳极室,纯水(含少量NaOH的水)加入阴极室,在电解过程中,阴极室与阳极室的变化如下:
通电时,H2O在阴极表面放电生成了H2,Na+穿过离子交换膜由阳极室进入阴极室。导出的阴极液中含有NaOH。即H2和NaOH是阴极产品。
Cl-则在阳极表面放电生成了Cl2,电解后的淡盐水从阳极导出,可重新用于配制食盐水。即Cl2是阳极产品。
可以看出,阳离子交换膜只允许阳离子(Na+)通过,把电解槽隔成了阴极室(精制饱和NaCl)和阳极室(含少量NaOH的水),而阻止阴离子(Cl-、OH-)和气体通过。
由此得出,阳离子交换膜在氯碱工业中的三个作用是:
①防止氯气与氢气混合而引起爆炸;
②避免氯气与氢氧化钠反应生成NaClO影响NaOH的产量;
③避免Cl-进入阴极区影响NaOH的纯度。
小结:离子交换膜实现了电化学反应器中两极产物的分隔,否则将发生各种副反应和次级反应,使产率大减,产品质量下降,并可能发生爆炸。
⑵质子交换膜在氢氧燃料电池中的应用
燃料电池是一种利用氧气和其他物质反应使化学能转换为电能的装置。质子交换膜燃料电池(PEMFCS)作为一种清洁能源已经被人们研发出来,这种电池主要应用于汽车和一些便携式电力装置。
质子交换膜(PMS)是燃料电池的主要部件,它分离了阴极和阳极;为质子传输提供了通道。对比于普通燃料电池的电解质而言,质子交换膜的主要优点是高的质子传导率、质量较轻、柔韧性较、较高的热稳定性和力学性能。
燃料电池是一种通过电化学反应直接将化学能转化为电能的装置。燃料电池的膜电极由气体扩散层、负极催化层、离子交换膜、正极催化层和气体扩散层构成。氢氧燃料电池正极和负极之间由质子交换膜隔开,它是电池的核心部件,对电池性能起着关键作用。
相对于内燃机,质子交换膜燃料电池(工作原理如右图)直接将化学能转化为电能,效率更高,又因为以氢气为燃料,最后作用的产物是水,没有生成任何有害气体释放到空气中,被世界认为是21世纪首选的洁净、高效的发电技术。
首先,氢气通过气体扩散层到达负极,在负极催化剂的作用下,1个H2分子产生2个氢质子(H+)和2个e-;在电池的另一端,H+通过质子交换膜、氧气(或空气)通过管道或导气板到达正极,在正极催化剂的作用下,氧分子和H+与通过外电路到达正极的电子发生反应生成水,从而形成电流。
由此得出,质子交换膜在氢氧燃料电池中的两个作用是:
①作为电解质提供质子(H+)的通道;
②作为隔离正、负两极气体的隔膜。
⑶离子交换膜在原电池中的应用
在原电池中,离子交换膜的作用与盐桥相似,将原电池分为正半电池和负半电池,从而提高原电池的工作效率.
【题型示例】
微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图1所示.下列有关微生物电池的说法错误的是( )
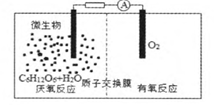
(A)正极反应中有CO2生成
(B)微生物促进了反应中电子的转移
(C)质子通过交换膜从负极区移向正极区
(C)电池总反应为:C6H12O6+6O2=6CO2+6H2O
【解析】在原电池中,负极发生氧化反应,正极发生还原反应.由图可知:通氧气的一极为正极,加葡萄糖的一极为负极;在原电池内部,阳离子向正极移动,故质子(H+)由负极区通过质子交换膜移向正极区.
(A)根据图知,负极上C6H12O6失电子,正极上O2得电子和H+反应生成水,负极的电极反应式为C6H12O6+6H2O—24e-=6CO2+24H+ 正极的电极反应式为O2+4e-+4H+=2H2O因此CO2在负极产生,故(A)错误。
(B)葡萄糖在微生物的作用下将化学能转化为电能,形成原电池,有电流产生,所以微生物促进了反应中电子的转移,故(B)正确。
(C)通过原电池的电极反应可知,负极区产生了H+,根据原电池中阳离子向正极移动,可知质子(H+)通过交换膜从负极区移向正极区,故(C)正确。
(D)该反应属于燃料电池,燃料电池的电池反应式和燃烧反应式相同,则电池反应式为C6H12O6+6O2=6CO2+6H2O;故(D)正确.
答案:(A)
技巧提醒
(1)在原电池中,正极区的阴离子通过阴离子交换膜到负极区;负极区的阳离子通过阳离子交换膜到正极区。
(2)相同时间内,外电路中通过电子所带电量等于内电路中通过离子交换膜的离子所带电量。
(3)如果为质子交换膜,一般负极反应要生成H+,正极反应要消耗H+。

- 全部评论(0)
