为什么氯化铝是共价化合物?
时间:2022-01-01 19:22 来源:未知 作者:化学自习室 点击: 次 所属专题: 共价化合物 氯化铝
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
氯化铝(AlCl3)是铝的特征卤化物,它和AlBr3、AlI3均为共价化合物,而AlF3则是离子化合物。
在高中化学知识里,我们讲到化学键类型的时候,也会提到,虽然大多数活泼金属和非金属之间,是以离子键结合的,但是氯化铝中是以共价键结合的,所以我们不能够通过用电解熔融的氯化铝的方式来得到金属铝,而是要电解熔融的氧化铝。同学们不禁要问,为何氯化铝中的铝和氯之间是以共价键结合的呢?下面危老师给大家详细道来。
首先,我们来了解氯化铝的分子结构:

但实际上,AlCl3在气态或者非极性溶剂中是二聚的:
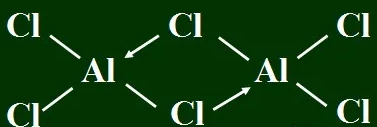
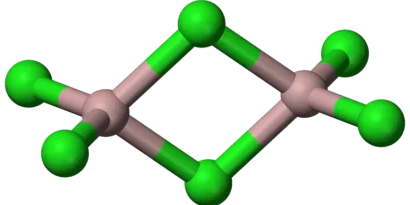
为什么AlCl3是双聚分子?
因为AlCl3是缺电子分子,铝原子最外层有空轨道,氯原子有孤对电子,铝原子采取sp3杂化,接受氯原子的一对孤对电子形成正四面体构型。两个AlCl3分子以氯桥键(三中心两电子键)结合形成Al2Cl6分子,这样的结构才会稳定。用高中知识来理解,可以认为铝原子要结合氯原子提供的一对电子才能形成最外层8电子的稳定结构。
Al和Cl原子之间,是通过共用电子对的形式结合的,没有形成Al3+和Cl-,因此,AlCl3是共价化合物。
前文提到,为何AlF3却是离子化合物,存在Al3+和F-,为何AlCl3中就没有形成Al3+和Cl-呢?
当然,我们可以用熔融状态的导电性实验来验证,熔融状态的AlCl3不导电,因此不存在自由移动的离子。从理论上来解析,是因为Al3+的离子半径很小,且所带电荷很高,它会对的Cl-电子产生影响,使其电子云发生“极化”,强烈的吸引Cl-的电子,使其电子对形成共用,因此不能形成完全意义上的Al3+和Cl-,换句话说,它们更趋向于通过共用电子对结合。
实际上,离子键与共价键没有本质区别,当成键原子的电负性(原子在化合物中吸引电子的能力标度)相差越小时,键更倾向共价键,反之键更倾向离子键。通常认为,电负性差值小于1.7的两种元素的原子之间形成极性共价键,相应的化合物是共价化合物。比如,铝的电负性为1.5,氯的电负性,3.0,氟的电负性为4.0,铝和氯的电负性相差1.5,形成共价键,铝和氟电负性相差2.5,形成离子键。
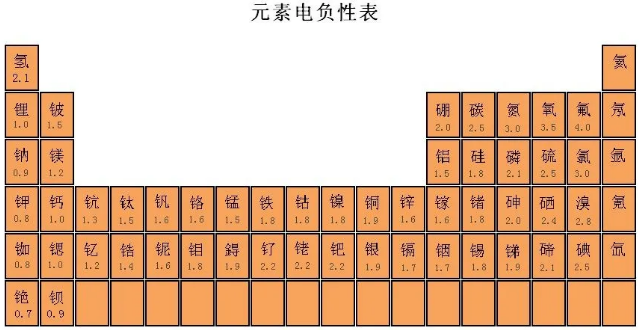
最后不得不说,原子与原子之间,并不是要么形成离子键、要么形成共价键。离子键和共价键只是我们人为的划分,电子的偏移和得失,其实没有一个明确的界限。在原子与原子形成化合物时,我们根据原子得失电子的能力大小,可以把它们之间的化学键理解为一部分离子键性质和一部分共价键性质,只是所占的比例不同。通过实验和理论研究得出AlCl3中共价键占的比例比较大,我们就认为它是由共价键结合的。

- 全部评论(0)
