共价键类型归纳总结
时间:2022-01-02 14:07 来源:未知 作者:化学自习室 点击: 次 所属专题: 共价键分类
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
多原子分子:多于两个原子的分子。多原子分子的化学键包括:定域键:双中心键(σ、π)和离域键:多中心键 。
⑴σ键:
成键时两原子轨道沿键轴(成键的两个原子间的连线称为键轴)方向进行,以“头碰头”的方式发生同号重叠。重叠的原子轨道绕键轴旋转时,呈圆柱形对称,图形和符号均不变化。σ键具有键能大、稳定性高的特点。
如:Cl2分子 Cl: 3s23p5
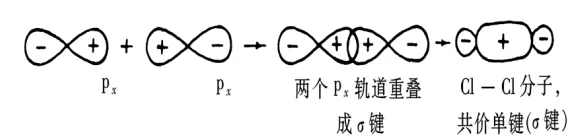
⑵π键:
原子轨道在核间联线两侧进行同号重叠(肩并肩重叠)。成键的原子轨道对通过键轴的一个节面呈反对称性,也就是成键轨道在该节面上下两部分图形一样,但符号相反。
如:N2分子 N: 2s22p3
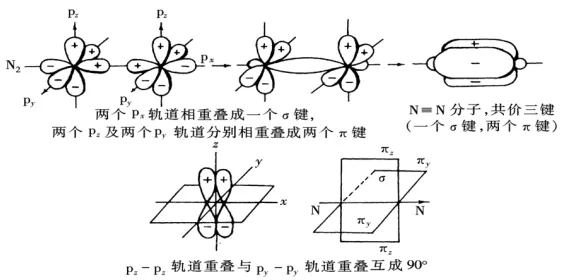
(3)配位键:
共价键中共用的两个电子通常由两个原子分别提供,但也可以由一个原子单独提供一对电子,由两个原子共用。
凡共用的一对电子由一个原子单独提供的共价键叫做配位共价键,简称为配位键。以“→”表示,方向是从提供电子对的原子指向接受电子对的原子。
配位键形成条件:成键原子一方有孤对电子,另一方有空轨道。
如:CO分子:C 2s22p2;O 2s22p4
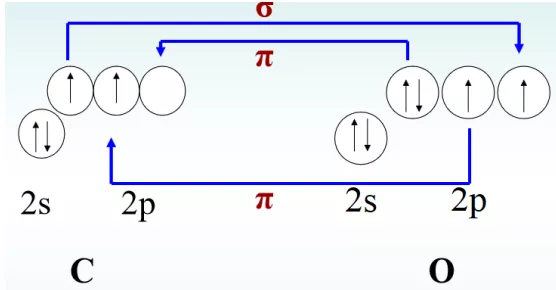
形成CO分子时,形成三个共价键。其中一对电子在形成共价键时具有特殊性:C和O各出一个2p轨道重叠,但其中的电子是由O单独提供的。这样的共价键称为共价配位键。于是, CO可表示成:
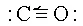
(4)离域π键
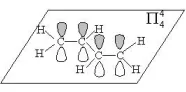
在一个平面形的多原子分子中,如果相邻原子中有垂直于分子平面的、对称性一致的、未参与杂化的原子轨道,那么这些轨道可以互相重叠,形成多中心π键,又称为“共轭π键”或“非定域π键”,简称大π键。
离域π键的形成条件:参与形成离域π键的原子都必须在同一平面上;每个原子都必须提供一个与分子平面垂直的原子轨道,如p或d轨道;参与离域的电子数m必须少于参与离域的原子数n的2倍,即m < 2n。离域π键用πnm来标记。
如:1, 3-丁二烯H2C=CH-CH=CH2
(5)d-p π键
以H3PO4((HO)3PO)为例,说明d-p π键的形成。
在(HO)3PO中P原子核外电子排布式为:1s22s22p63s23p33d0;P原子采取sp3杂化。
P原子中3个sp3杂化轨道中的3个单电子与OH基团形成三个σ键,第四个sp3杂化轨道上的孤对电子对必须占有O原子的空的2p轨道。而基态氧原子2p轨道上的电子排布为2p4,没有空轨道,但为了容纳p原子上的孤对电子对,O原子只好重排2p轨道上电子而空出一个2p轨道,如下图所示:

以此来容纳P原子的孤对电子对,形成σ配位键。

氧原子2P轨道上的孤对电子对反过来又可以占有P原子的3d空轨道,这两个p-d轨道只能“肩并肩”重叠,形成π键,称为d-p π键。所以P、O之间的成键为(一个σ配键,两个d-p π配位键),相当于P=O。
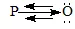
可把H3PO4的结构式表示为:


- 全部评论(0)
