与配位共价键有关的几个问题
时间:2021-11-07 18:19 来源:未知 作者:王笃年 点击: 次 所属专题: 配位键
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
共价键是指成键的原子间通过共用1对或几对 电子而形成的化学键,通常,这些电子对是由成键的原子双方共同提供的,如H2、HCl、H2O中的共价键 都是如此,那么,有没有这样的共价键,其共用电子对是由参与成键的原子单方面提供的呢?
首先,让我们来看一看NH4+的形成过程:NH3 可以与酸作用形成NH4+ ,这个反应可以用离子方程 式表示为:NH3 + H+=NH4+那么,NH4+中,NH3与 H+是怎样结合的呢?
我们知道,氮原子的最外层上共有5个电子,其 中有3个原来是成单的电子。氮与氢化合时,这3个 成单电子分别和1个氢原子的电子配对,形成了 3对 共用电子对。而另外的2个电子本来就是1对,它们 没有参与成键.这样的电子对叫“孤对电子"或“孤电 子对”。
H+是氢的原子核,实际上就是1个裸露的质子,带有1个単位的正电荷,对电子或电子对有强烈的吸引作用,它“迫切地期望“能有1对电了进入自己核外的轨道上运动,从而达到最外层(K层)有2个电子的 稳定结构。
这样,当NH3与H+相遇时,NH3中的氮原子就 充许从其孤对电子的一边靠近,并使自己的“孤电 子对”进入H+的核外空间运动,从而把NH3和H- 结合起来,形成了稳定的NH4+
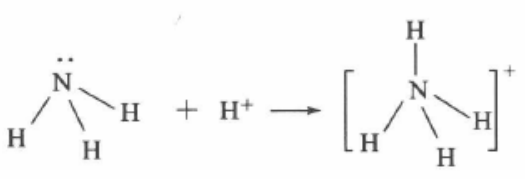
像上述NH3中的氮原子单方面提供电子对与氢 原子共用而形成的共价键,叫作配位键。
显然,形成配位键的基本条件是.成键的双方原 子中,必须一方具有孤对电子而另一方具备与之相匹 配(指能址接近、方向性适合)的空轨道。为表示配位键与一般的共价键的不同,往往在表示共价键的短线上加一箭头“→”,箭头由提供电子对的原子指向另一 原子(提供空轨道的原子)。
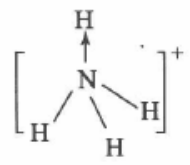
值得注意的是,配位键与一般 H共价键虽然形成过程不同,而一旦 形成之后,其性质则与一般共价键完全一样。实验测得,NH4+中,4个 “N—H”的键长、键能都相等,而且4条共价键中任意 2条键间的夹角都相等,为109°28,NH4+呈正四面体结构。所以,上述箭头不写岀也是可以的。
关于配位键的形成,无机化学教科书上也经常举 CO分子的例子:碳原子最外层有2个成单电子,先与氧原子最外层上的2个单电子形成2条一般共价键, 这时,对氧原子来说,其最外层已有8个电子,而碳原 子最外层上却只有6个电子,没有达到8个电子的稳 定结构.于是,氧原子把自己的1对孤对电子提供出 来与碳原子共用,形成1条配位键。这样对氧原子来 说“没有什么损失”,最外层上还是8个电子的稳定结 构,而碳原子也满足了最外层的8电子稳定结构,CO 的分子结构可用下式表示:C O。
O。
常见粒子中,水合氢离子H3O+也是H2O以其 氧原子上的1个孤电子对与H+共用,通过配位键结 合而形成的,请你自己研究其形成过程。
还有一个有趣的例子足以说明配位键与一般共价键的差别只是形成过程不同,而性质是完全一样的,这就是水分子的2条不同形成途径:
氢原子和氧原子结合![]() ,形成一般共价键。
,形成一般共价键。
H+与OH-中和:H++OH-=H2O,形成配位键(OH-中氧原子的孤对电子向H+配位)。
我们看到,虽然这2条途径不同,但所形成的水 分子的性质却没有任何差别。
另外,很多含氧酸分子如H2SO4,HNO3、H3PO4及其酸根离子中,也都含有配位键,请同学们利用课余时间加以研究.
除以上介绍的简单分子、离子外,更多的配位键 存在于一大类化合物中,这类化合物叫作配位化合物,简称“配合物”或“络合物”。常见的配位化合物有 [Cu(H2O)4 SO4、[Cu(NH3)4] SO4、Fe(SCN)3、 [Ag(NH3)2]OH、Na3AlF6(冰晶石的主要成分)等。
配位化合物与生产、生活及科学研究有若密切联系,研究配位化合物的学问叫作配位化学,有兴趣的同学可以在课余时间加以学习和探究。

- 全部评论(0)
