与胶体有关的疑难问题汇总
时间:2022-02-08 18:37 来源:未知 作者:化学自习室 点击: 次 所属专题: 胶体
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
如题高中化学教材对胶体的介绍由于展开不够充分,使不少学生和教师难以把握有关内容,出现了一系列的模糊认识。本文汇总了一些与胶体有关的疑难问题,并对有些问题进行了一定拓展。
1、溶胶与胶体有何关系?
胶体从外观上看貌似均匀,与溶液没什么差异,因此胶体常称为溶胶。也就是说,可以认为溶胶与胶体是同一个概念。
2、对淀粉、蛋白质等高分子溶于水形成的分散系,为什么有时称其为溶液,有时又称其为胶体?
根据分散质微粒的大小可将分散系称为溶液、胶体、浊液三类,但胶体与溶液的差异不仅是分散质微粒大小的不同,还有其构造上的差异。若分散质微粒是离子或单个分子,则这样的分散系叫溶液。胶体中分散质的微粒结构比较复杂。
淀粉、蛋白质等都是以分子形式分散在水中的,因此,形成的分散系都应叫溶液。只是由于这些分子很大,已经达到胶体范围,具有胶体的一些特征。如不能透过半透膜、有丁达尔现象,所以也可称为胶体。
化学上常把Fe(OH)3,AgI等难溶于水的物质形成的胶体称为憎液胶体,简称溶胶;而把淀粉、蛋白质等易溶于水的物质形成的分散系称为亲液胶体,更多的是称为高分子溶液。
3、溶液是均一的,胶体也均一吗?
憎液溶胶的分散质微粒是由很大数目的分子构成,因此是不均一的;高分子溶液中的分散质微粒是单个的分子,因此是均一的。
4、胶体能在较长时间内稳定存在的原因是什么?
憎液溶胶的胶粒带有相同的电荷,由于同性电荷的排斥作用而使憎液胶体可以稳定存在。淀粉、蛋白质等高分子中含有多个极性基团(如—COOH,—OH,—NH2等),可以与水高度溶剂化(高分子表面形成水膜),因此也可较长时间稳定存在。很明显,这两类胶体稳定存在的原因是不同的。
5、制备Fe(OH)3胶体的体系中含有大量氯离子,它们为何不能使Fe(OH)3胶体聚沉?
外加电解质时,体系内离子总浓度大大地增高,因此给带电的胶粒创造了吸引异性离子的条件,胶粒原来所带电荷会减少甚至完全被中和,胶粒间斥力大大减少,以致胶粒互碰后引起聚集变大而迅速聚沉。电解质的聚沉能力主要由异性(与溶胶粒子所带电荷符号相反)离子的价态决定,离子价态越高,电解质聚沉能力越大。
加热煮沸FeCl3溶液制得的Fe(OH)3溶胶的胶团结构如下:
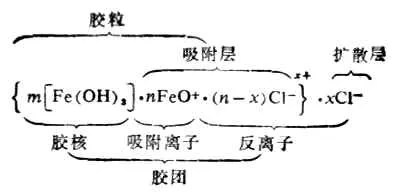
一般胶粒吸附的离子是形成胶核的成份(大学知识),所以氢氧化铁胶体容易吸附铁离子或氢氧根。而在制备氢氧化铁的环境中,铁离子比较多,因此吸附铁离子而使得氢氧化铁胶粒带正电荷。
从上述原理推断,制备Fe(OH)3胶体体系中的氯离子应该也能使Fe(OH)3胶体聚沉,但实际上却并非如此。这是为什么呢?
从以上结构可看到, Fe(OH)3胶体中的氯离子主要存在于胶粒的吸附层和胶团的扩散层中,它们起不到凝聚作用,并且吸附层中离子的水化作用使胶粒被水包围,也会阻止胶粒间的相互接近,也就阻止了胶体粒子继续变大而聚沉的可能性。
6、为何说丁达尔现象是胶体的特征现象?是否所有胶体都能出现丁达尔现象?
丁达尔现象起源于光的散射。散射光的强度随着颗粒半径增加而变化。一般来说,胶体分散质粒子直径小于入射光的波长。所以,当一束强光照射到胶体时,有一部分光被粒子散射,即从该粒子向各个方向传播,这时粒子本身好像一个发光体向各个方向发射出光线。胶体体系中无数个分散质粒子散射的结果,就产生了丁达尔现象。悬(浮)浊液分散质微粒直径太大,对于入射光只有反射而不散射;溶液里溶质微粒太小,对于入射光散射很微弱,观察不到丁达尔现象。所以说丁达尔现象是胶体的特征现象。
是否所有胶体都能显现丁达尔现象呢?碳素墨水是胶体,但它就很难显现丁达尔现象,这是因为墨水中的黑色物质对可见光具有很强的吸收作用。另外散射光的强度还随着微粒浓度减小而减小,若实验时溶胶浓度太稀也很难观察到明显的丁达尔现象。
7、聚沉与盐析有何差别?为什么胶体聚沉是不可逆的,而蛋白质溶液的盐析是可逆的?
聚沉是憎液胶体的性质,胶体的聚沉过程就是胶粒聚集成较大颗粒的过程。由于憎液胶体的分散质都难溶于水,因此,再用水来溶解胶体的聚沉物是不可能的。也就是说,胶体的聚沉是不可逆的。
亲液溶胶的稳定性主要由于胶粒高度的溶剂化作用所致,与电荷无关。有机高分子带有大量的一OH、一COOH、 一NH2等亲水基,这些基团的水化作用很强(即以氢键和水分子结合),使有机分子外围有很厚的水化膜,阻止髙分子化合物的聚集。当往这类溶胶中加入少量盐[如Na2SO4等],盐的离子反而被有机高分子选择吸附,使表层带电且彼此排斥,与水分子间的作用反而加强,因而使有机物的溶解度反而增大,这种现象称为盐溶。而加入浓的盐溶液,使水的活度降低,原来溶液中的大部分自由水转变为盐离子的水化水,从而降低了有机髙分子的亲水基团与水分子间的相互作用,破坏了表面的水膜,失去其保持稳定性的因素而发生聚沉,这一过程叫盐析。向析出的沉淀中继续加入水时,使电解质的浓度减少,沉淀物会重新溶解。
8、蔗糖溶于水形成的分散系是溶液,为什么在生物课的渗透实验中,蔗糖分子却不能通过半透膜?
不同的半透膜,如羊皮纸、动物膀胱膜、玻璃纸等,其细孔的直径是不同的。也就是说,不同的半透膜,其通透性是不一样的。显然,笼统地讲半透膜能使离子或分子通过,而不能使胶体微粒通过其实是不恰当的。
9、憎液胶体与高分子溶液在性质上有何异同?
憎液胶体全面地表现出胶体的特性,高分子溶液则不然。
这两种分散系中的分散质微粒都作布朗运动,都有丁达尔现象。
憎液胶体有电泳现象,淀粉溶液无电泳现象,而蛋白质溶液则较为复杂。
使憎液胶体凝聚的方法有:加入电解质、给胶体加热、加入带相反电荷的胶体。使高分子溶液中的分散质沉淀,主要是破坏高子分与分散剂间的相互作用,如加入大量的电解质也能使淀粉、蛋白质沉淀,这一现象称为盐析,它是可逆的。
10、Fe(OH)3胶体长时间电泳或电压增大,将发生怎样的现象?
如果Fe(OH)3胶体长时间电泳或将电泳的电压显著增大,都会在阴极出现聚沉现象。因为不论是长时间电泳还是电压显著增大,都会使阴极附近积聚很多的Fe(OH)3胶粒,大量胶粒的聚集必然会出现凝聚现象。如果电泳电压特别大,还会出现电解水的现象。

- 全部评论(0)
