s-p-d型或d-s-p型杂化轨道介绍练习
时间:2022-05-27 09:16 来源:未知 作者:化学自习室 点击: 次 所属专题: 杂化轨道理论
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
原子在形成化学键时除采用s-p型杂化外,还可以采用s-p-d型或d-s-p型杂化。
1.s-p-d型杂化
ns轨道、np轨道和nd轨道一起参与的杂化称为s-p-d型杂化,主要有以下几种类型:
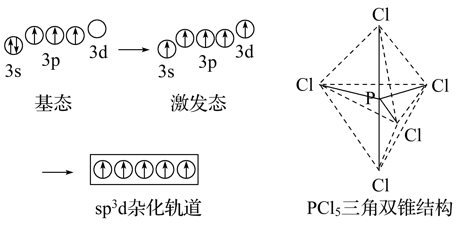
(1)sp3d杂化
sp3d杂化轨道是由1个ns轨道、3个np轨道和1个nd轨道组合而成的,它的特点是5个杂化轨道在空间呈三角双锥形,杂化轨道间夹角为90 或120°。
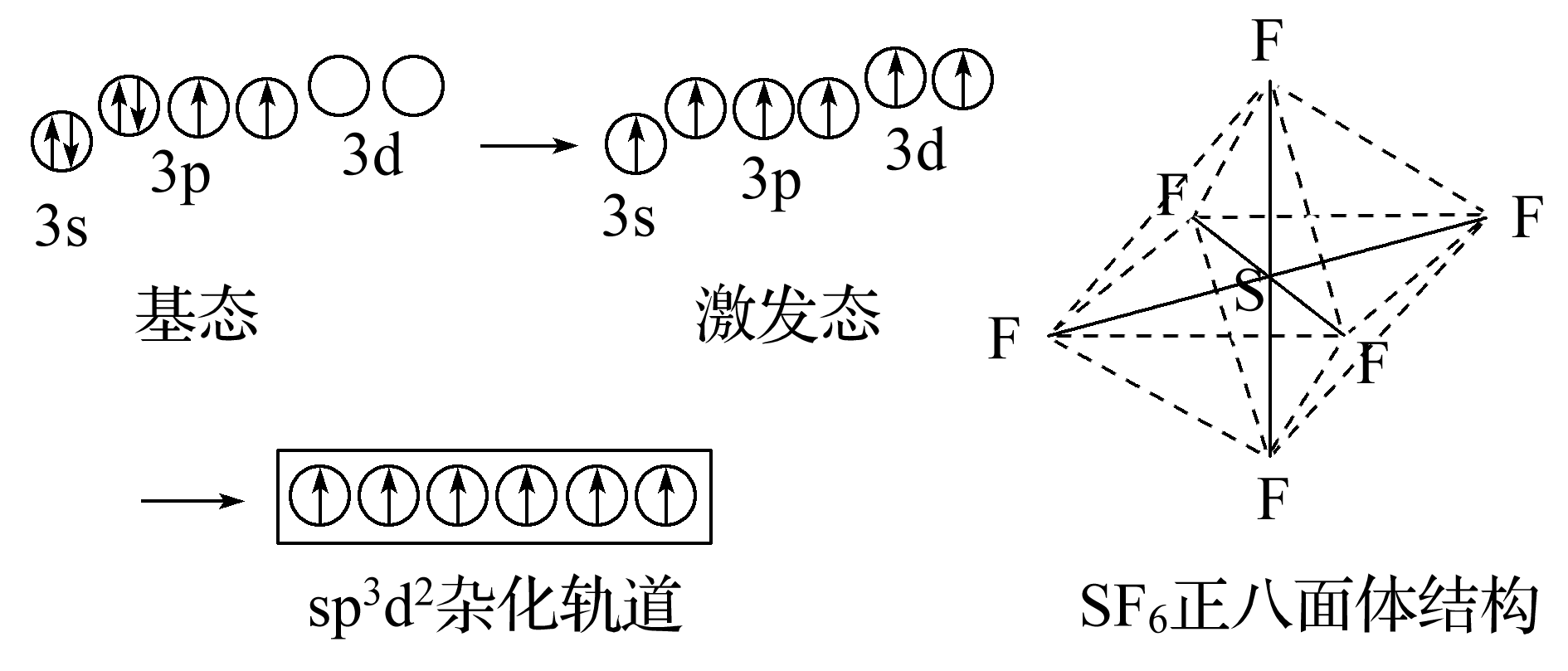
(2)sp3d2杂化
sp3d2杂化轨道由1个ns轨道、3 个np轨道和2个nd轨道组合而成,它的特点是6个杂化轨道指向正八面体的6个顶点,杂化轨道间夹角为90° 或180°。
(3)sp3d3杂化也是s-p-d 型杂化的一种。
sp3d3杂化轨道是由1个ns轨道、3个np轨道和3个nd轨道组合而成的,它的特点是7个杂化轨道在空间呈五角双锥形。
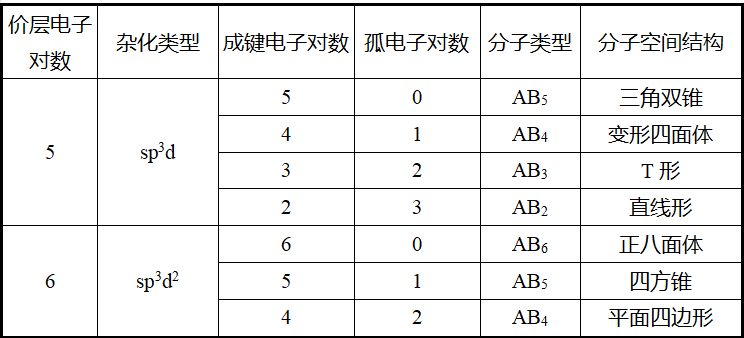
(4)价层电子对数与分子空间结构
2.d-s-p型杂化
(n-1)d轨道和ns轨道、np轨道一起参与的杂化称为d-s-p型杂化。主要是过渡元素的原子或离子在与CN-、NO2-等形成配位键时采用的杂化方式,常见有
杂化轨道类型 | 价层电子对数 | 空间结构 | 实例 |
dsp2 | 4 | 四方形 | [Ni(CN)4]2- |
dsp3 | 5 | 三角双锥 | Fe(CO)5 |
d2sp3 | 6 | 八面体 | [Fe (CN)6]3- |
典型例题:
1.(2021·全国甲卷节选)我国科学家研发的全球首套千吨级太阳能燃料合成项目被形象地称为“液态阳光”计划。该项目通过太阳能发电电解水制氢,再采用高选择性催化剂将二氧化碳加氢合成甲醇。SiCl4是生产高纯硅的前驱体,其中Si采取的杂化类型为________________。SiCl4可发生水解反应,机理如下:
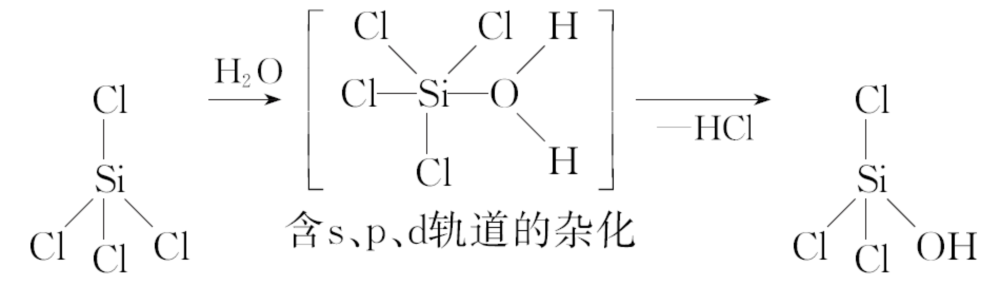
含s、p、d轨道的杂化类型有①dsp2、②sp3d、③sp3d2,中间体SiCl4(H2O)中Si采取的杂化类型为____________(填标号)。
【解析】SiCl4中Si原子价层电子对数为4+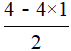 =4,因此Si原子采取sp3杂化;由图可知,SiCl4(H2O)中Si原子的σ键数为5,说明Si原子的杂化轨道数为5,由此可知Si原子的杂化类型为sp3d。
=4,因此Si原子采取sp3杂化;由图可知,SiCl4(H2O)中Si原子的σ键数为5,说明Si原子的杂化轨道数为5,由此可知Si原子的杂化类型为sp3d。
答案:sp3 ②
2.(2021·山东等级考节选)非金属氟化物在生产、生活和科研中应用广泛。Xe是第五周期的稀有气体元素,与F形成的XeF2室温下易升华。XeF2中心原子的价层电子对数为__________,下列对XeF2中心原子杂化方式推断合理的是__________(填标号)。
A.sp B.sp2 C.sp3 d.sp3d
【解析】XeF2易升华,所以是分子晶体,其中心原子的价层电子对数为2+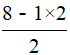 =5,其中心原子的杂化方式应为sp3d。
=5,其中心原子的杂化方式应为sp3d。
答案:5 D
1.(原创题)第ⅤA族元素的原子As与Cl原子结合可以形成AsCl3、AsCl5分子。下列关于AsCl3和AsCl5的说法正确的是( )
A.AsCl3和AsCl5分子中每个原子的最外层都达到8电子稳定结构
B.AsCl3和AsCl5分子都是由极性键构成的极性分子
C.AsCl3分子的空间结构是平面三角形
D.AsCl5分子中As采用sp3d杂化
【解析】选D。AsCl5分子中As原子最外层有10个电子,并不是最外层8个电子的稳定结构,因此AsCl5分子中As原子的最外层不是8电子稳定结构,A错误;AsCl5分子中心原子的价层电子对数为5+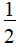 ×(5-1×5)=5,As采用sp3d杂化,没有孤电子对,因此分子为三角双锥,结构对称,分子中正负电荷重心重合,因此该分子为非极性分子;AsCl3分子中心原子的价层电子对数为3+
×(5-1×5)=5,As采用sp3d杂化,没有孤电子对,因此分子为三角双锥,结构对称,分子中正负电荷重心重合,因此该分子为非极性分子;AsCl3分子中心原子的价层电子对数为3+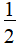 ×(5-1×3)=4,As采用sp3杂化,成键电子对数是3,孤电子对数是
×(5-1×3)=4,As采用sp3杂化,成键电子对数是3,孤电子对数是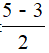 =1,所以AsCl3分子的空间结构是三角锥形,为极性分子,故B、C错误;D正确。
=1,所以AsCl3分子的空间结构是三角锥形,为极性分子,故B、C错误;D正确。
2.(双选)(原创题)SF4是一种选择性有机氟化剂,常温下为气体,有毒,已知 SF4气体可转化为SF6气体,SF6气体可引起温室效应,排放在大气中的SF6气体寿命约3400年,是国际限制排放的六种气体之一。判断下列说法正确的是( )
A.SF4的VSEPR模型与分子结构不同
B.SF4、SF6中各原子均达到最外层8电子稳定结构
C.SF4、SF6分子均是由极性键形成的极性分子
【解析】选A、D。SF4中心硫原子的价层电子对数为4+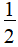 ×(6-1×4)=5,因此VSEPR模型为三角双锥形,孤电子对数为1,因此分子结构为变形四面体,故A项正确;S原子的最外层有6个电子,在SF4、SF6分子中,S原子分别形成了4个、6个共价键,最外层不是8电子稳定结构,故b错误:SF6中心硫原子的价层电子对数为6+
×(6-1×4)=5,因此VSEPR模型为三角双锥形,孤电子对数为1,因此分子结构为变形四面体,故A项正确;S原子的最外层有6个电子,在SF4、SF6分子中,S原子分别形成了4个、6个共价键,最外层不是8电子稳定结构,故b错误:SF6中心硫原子的价层电子对数为6+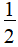 ×(6-1×6)=6,孤电子对数为0,因此分子为正八面体结构,正负电荷重心重合,是非极性分子,故C错误;SF6中S和F中间都是单键(σ键),分子是正八面体结构,分子中心的硫原子到氟原子的距离相等,化学键相同,故键长、键能都相等,故D正确。
×(6-1×6)=6,孤电子对数为0,因此分子为正八面体结构,正负电荷重心重合,是非极性分子,故C错误;SF6中S和F中间都是单键(σ键),分子是正八面体结构,分子中心的硫原子到氟原子的距离相等,化学键相同,故键长、键能都相等,故D正确。
3.(改编题)PCl5是一种白色晶体,熔融时形成一种能导电的液体,测得其中含有一种正四面体形阳离子和一种多核阴离子,这两种离子的化学式为___________;阴离子的空间结构为_________,中心原子采用的杂化类型为________。正四面体形阳离子中键角__________PCl3的键角(填“>”“<”或“=”),原因是__________。
【解析】PCl5是一种白色晶体,形成一种能导电的熔体,说明生成自由移动的阴阳离子,一种正四面体形阳离子应为AB4的形式,根据化合价可以判断为PCl4+,阴离子为多核阴离子,因此只能是PCl6-;PCl6-中价层电子对数=6+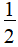 ×(5-1×6+1)=6,故P原子杂化方式是sp3d2,孤电子对数为0,因此PCl6-为正八面体形;PCl3中价层电子对数=3+
×(5-1×6+1)=6,故P原子杂化方式是sp3d2,孤电子对数为0,因此PCl6-为正八面体形;PCl3中价层电子对数=3+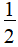 ×(5-1×3)=4,P原子杂化方式是sp3,PCl3分子中P原子有一对孤电子对,PCl4+中价层电子对数=4+
×(5-1×3)=4,P原子杂化方式是sp3,PCl3分子中P原子有一对孤电子对,PCl4+中价层电子对数=4+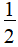 ×(5-1×4-1)=4,孤电子对数为0,孤电子对对成键电子对的排斥力大于成键电子对间的排斥力,所以PCl5中正四面体形阳离子(PCl4+)中键角大于PCl3的键角。
×(5-1×4-1)=4,孤电子对数为0,孤电子对对成键电子对的排斥力大于成键电子对间的排斥力,所以PCl5中正四面体形阳离子(PCl4+)中键角大于PCl3的键角。
答案:PCl4+和PCl6- 正八面体形 sp3d2 > PCl3中P原子有一对孤电子对,PCl4+中P没有孤电子对,孤电子对对成键电子对的排斥力大于成键电子对间的排斥力

- 全部评论(0)
