原子轨道为什么要进行杂化
时间:2021-07-18 20:08 来源:未知 作者:化学自习室 点击: 次 所属专题: 杂化轨道理论
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
原子轨道为什么要进行杂化?
杂化是指在形成分子时, 由于原子的相互影响, 若干不同类型能量相近的原子轨道混合起来, 重新组合成一组新轨道。 这种轨道重新组合的过程叫杂化, 所形成的新轨道就称为杂化轨道。杂化轨道理论认为在形成分子时,通常存在激发、杂化和轨道重叠等过程。如 CH4分子的形成过程:碳原子2s轨道中1个电子吸收能量跃迁到 2p空轨道上,这个过程称为激发, 但此时各个轨道的能量并不完全相同, 于是1个2s轨道和3个2p轨道“混合”起来,形成能量相等、成分相同的 4个sp3杂化轨道。然后 4个sp3杂化轨道上的电子间相互排斥,使四个杂化轨道指向空间距离最远的正四面体的四个顶点, 碳原子的 4个sp3杂化轨道分别与 4个H原子的1s轨道形成4个相同的σ键,从而形成 CH4分子。由于四个 C-H键完全相同,所以形成的 CH4分子为正四面体,键角 109°28'。
什么是原子杂化轨道?为什么要杂化?
在形成分子的过程中, 由于原子间的相互影响, 若干类型不同而能量相近的 原子轨道相互混杂,重新组合成一组能量相等, 成分相同的新轨道, 这一过程称为杂化。 经过杂化而形成的新轨道叫做杂化轨道,杂化轨道与其他原子轨道重叠时形成 σ共价键。原子在形成分子的过程中,为了使所成化学键强度更大,更有利于体系能量的降低, 总趋向于将原来的原子轨道 进一步线性组合,以形成新的原子轨道。
价键理论对共价键的本质和特点做了有力的论证, 但它把讨论的基础放在共用一对电子形成一个共价键上, 在解释许多分子、 原子的价键数目及分子空间结构时却遇到了困难。 例如C原子的价电子是2s22p2,按电子排布规律,2个S电子是已配对的, 只有2个p电子未成对,而许多含碳化合物中 C都呈4价而不是 2价,可以设想有 1个s电子激发到 p轨道去了。那么 1个s轨道和3个p轨道都有不成对电子,可以形成 4个共价键,但s和p的成键方向和能量应该是不同的。而实验证明: CH4分子中,4个C-H共价键是完全等同的, 键长为 114pm,键角为 109°28'。BCl3,BeCl2,PCl3等许多分子也都有类似的情况。为了解释这些矛盾, 1928年鲍林(Pauling)提出了杂化轨道概念 ,丰富和发展了的价键理论。他根据量子力学的观点提出:在同一个原子中, 能量相近的不同类型的几个原子轨道在成键时,可以互相叠加重组,成为相同数目、能量相等的新轨道,这种新轨道叫杂化轨道。 C原子中1个2s电子激发到 2p后,1个2s轨道和3个2p轨道重新组合成 4个sp3杂化轨道,它们再和 4个H原子形成4个相同的 C-H键,C 位于正四面体中心,4个H 位于四个顶角。
杂化轨道种类很多,如 三氯化硼(BCl3)分子中 B有sp2杂化轨道,即由 1个s轨道和2个 p 轨道组合成 3 个 sp2 杂化轨道,在氯化铍 (BeCl2) 中有 sp 杂化轨道,在 过渡金属 化合物中还有 d 轨道参与的 sp3d 和 sp3d2 杂化轨道等。以上几例都是阐明了共价单键的性质,至于乙烯和 乙炔分子中的双键和三键的形成, 又提出了 σ键和 π键的概念。 如把两个成键原子核间联线叫键轴, 把原子轨道沿键轴方向 “头碰头 ”的方式重叠成键, 称为 σ键。把原子轨道沿键轴方向 “肩并肩 ”的方式重叠,称为 π 键。例如在乙烯 (CH2= CH2)分子中有碳碳双键(C=C),碳原子的激发态中2Px,2Py和2s形成sp2杂化轨道,这 3个轨道能量相等,位于同一平面并互成 120℃夹角,另外一个 Pz 轨道未参与杂化,位于与平面垂直的方向上。碳碳双键中的 sp2杂化如下所示。
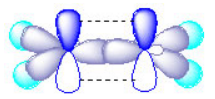
这3个sp2杂化轨道中有 2个轨道分别与 2个H原子形成σ单键,还有1个sp2轨道则与另一个 C的sp2轨道形成头对头的 σ键,同时位于垂直方向的 pz轨道则以肩并肩的方式形成了π键。也就是说碳碳双键是由一个 σ键和一个π键组成,即双键中两个键是不等同的。
π键原子轨道的重叠程度小于 σ键,π键不稳定,容易断裂,所以含有双键的 烯烃很容易发生加成反应,如乙烯(H2C=CH2)和氯(Cl2)反应生成氯乙烯(Cl—CH2—CH2—Cl)。
乙炔分子(C2H2)中有碳碳叁键(HC≡CH),激发态的 C原子中2s和2px轨道形成sp杂化轨道。这两个能量相等的 sp杂化轨道在同一直线上,其中之一与 H原子形成σ单键,另外一个sp杂化轨道形成 C原子之间的 σ键,而未参与杂化的 Py与Pz则垂直于 X轴并互相垂直,它们以肩并肩的方式与另一个 C的Py,Pz形成π键。即碳碳叁键是由一个 σ键和两个π键组成。这两个 π键不同于σ键,轨道重叠也较少并不稳定,因而容易断开,所以含叁键的炔烃 也容易发生加成反应。
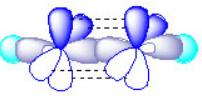
杂化轨道限于最外层电子, 而在第一层的两个电子不参与反应, 而在其他层上有许多的轨道,电子会从能量低的层 “跃迁”到能量高的层,而原来能量低的层是因为电子的运动方向相反,而跃迁以后电子就只向一种方向运动, 所以能量会高。并且反应以后组成的能量介于原来的s轨道和p轨道能量之间。

- 全部评论(0)
(550484216) 评论 href="/plus/view.php?aid=19898">原子轨道为什么要进:请问氮气分子的杂化和反应时是先断裂 σ键还是π键 σ键和π键能
(550484216) 评论 href="/plus/view.php?aid=19898">原子轨道为什么要进:请问氮气分子的杂化和反应时是先断裂 σ键还是π键 σ键和π键能
(550484216) 评论 href="/plus/view.php?aid=19898">原子轨道为什么要进:请问氮气分子的杂化和反应时是先断裂 σ键还是π键 σ键和π键能
