浅析杂化轨道理论与价电子对互斥理论的理解与应用
时间:2016-04-01 11:43 来源:江苏沛县中学 作者:郝凯军 点击: 次 所属专题: 价电子对互斥理论 杂化轨道理论
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
杂化轨道理论与价电子对互斥理论是 高中选修化学《物质结构与性质》中的重点与难点,并且这部分教材对很多教师来说 还是崭新的内容,笔者对于这部分内容有 一些体会,想与大家分享。
一、轨道进行杂化的原因
原子为了更好的成键。这里的“更好” 包括“更多”和“更强”。以CH4为例:按照传 统的结构玮论,C原子的外围电子轨道表 示式为(图一),且2p的两个有单电子的轨道相互垂直,那么C就只能结合两个H原 子,并且C-H键角为90°。而CH4中的C却 结合了 4个H,C-H键角为109°28',这样 CH4中的C就成了“更多”的键;根据元素周期律:C元素的非金属性较弱,似我们知道CH4的稳定性还是很强的,这样CH4中 的C就成了“更强”的键。由此我们对CH4 中C的轨道在成键过程中的变化情况可作 出以下假设:(图二)。这就是C的一种杂化方式即sp3杂化
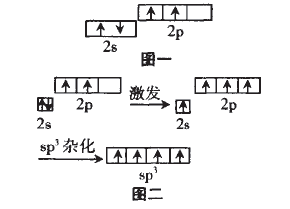
二、杂化轨道理论要点
1. 某些原子(C、N、O、S等)在某些物质 中为更好的结合其他原子而对轨道进行 杂化。
2. 同一原子中不同类型,能量相近的 轨道参与杂化。
3. 杂化前后轨道总数不变。
4. 杂化后的轨道上如有单电子则去成σ键,未参与杂化的轨道上如有单电子则去成π键。
根据这一理论,我们可以对BF3和 BeCl2中的B和Be的杂化情况作出分析:
(1)用轨道表示式表示B原子采取sp2 杂化轨道成键的形成过程:
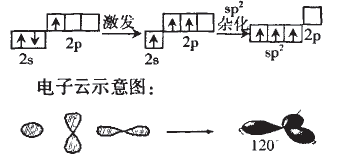
对B的sp2杂化我们根据杂化理论有 以下认识:
①每个sp2杂化轨道占有1/3个s,2/3个p轨道。
②sp1杂化轨道呈平面三角型,轨道间夹角为120° ;
③中心原子通过sp2杂化轨道成键的分子有C6H6、C2H4等。
(2)用轨道表不式表示 Be原子采取sp 杂化轨道成键的形成过程
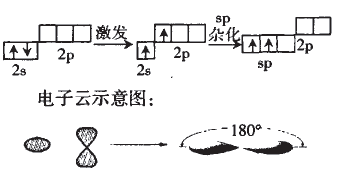
对Be的Sp杂化我们根据杂化理论有以下认识:
①每个sp杂化轨道占有1/2个s轨道,1/2个p轨道。
②sp杂化轨道呈直线型,轨道间夹角为180° ;
③中心原子通过sp杂化轨道成键的分子有CO2、C2H2等。
再以O原子为例,O原子的sp 杂化过程:
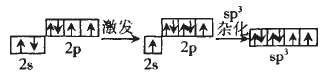
对O的sp3杂化的认识是:
①杂化后的轨道数=杂化前的轨道数=4
②杂化后的4个轨道不完全相同。
③有单电子的杂化轨道参与形成σ键。 那么怎样解释H2O中键角为104.5°,而不是180°呢?这就要用到价电子对互斥 理论了。
三、价电子对互斥理论
1. 价电子对包括成键电子对和孤电 子对。
2. 价电子对之间相互排斥而趋向尽可 能彼此远离以减小斥力,分子尽可能采取对称的空间构型。
3. 斥力大小顺序为:孤对电子对—孤对电子对> 孤对电子对—成键电子对 > 成键电子对—成键电子对
4.对于ABm型分子价层对数目(n)= (中心原子A的价电数+配位原子B提供 的价电子数×m)÷2。
5.O、S作为配位原子时按不提供价电 子计算,作中心原子时价电子数为6。
由此我们就可以解释H2O中键角为 104.5°而不是180°。即:O原子成4个价电 子对,其中两个成键电子对,两个孤电子对, 由于成键电子对之间的斥力小于与孤电子对之间的斥力,故H2O中O-H键之间的夹角减小而小于180°,实际表现为104.5°。
四、典型例题
1.关于杂化方式的考察
例1.下列各微粒的中心原子采用了sp3杂化的是 ( )
A.NH4+ B.CO2 C.H2O D.SCl6
解析:当价电子对数n分别为4、3、2, 对应的杂化方式分别为sp3、sp2、sp。四个 选项对应的价电子对数n分别为: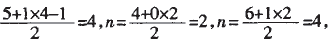
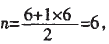
故答案为A,C。
2. 关于空间构型的考察
例2.下列分子的空间构塑分别为: ① BeCl2;②H2O;③NH3;④PCl3.
解析:这儿种都是ABm型分子,它们 的价电子对数n分别为2、4、4、4,其中① BeCl2的n=m=2,其空间构型为对称的直线 型。而②H2O中n=4,m=2,n不等于m其空间构型为不对称的“V”字型;③NH3中的 n=4,m=3,n不等于m,其空间构型为不对 称的三角锥型;④PCl3中n=4,m=3,n不等于m,其空间构型为不对称的三角锥型。
2. 分子极性的考察
例3.下列分子属于极性分子的是( )
A.H2O B.CCl4 C.CS2 D.PH3
解析:
A.H2O中n=4,n=2,n大于m,说明O原子所成的价电子对中除成键电子对 外还有孤电子对,由于成键电子对与孤电 子对之间的斥力不同,其空间构型为不对 称的“V”字型,正负电荷重心不重合,故为极性分子。
B.CCl4中n=4,m=4,n=m,说明C 原子所成的价电子对全是一样的成键电子对,它们之间的斥力完全相同,其空间构型 为正四面体型,正负电荷重心重合,故为非 极性分子。
C.CS2中n=m=2,说明C原子所 成的价电子对全是一样的成键电子对,其空间构型为直线型,正负电荷重心重合,故 为非极性分子。
D.PH3中n=4,m=3,n大于 m,说明P原子所成的价电子对中还有孤电子对,由于成键电子对与孤电子对之间 的斥力不同,其空间构型为不对称的三角 锥型,正负电荷重心不重合,故为极性分 子。
答案为AD。
4.物质结构式的考察
例4.请写出H2SO4和HNO3的结构式。
解析:H2SO4中S的杂化方式与SO42-的应该一样,SO42-中n=4,故S的杂化方式为sp3。用轨道表示式可表示如下:
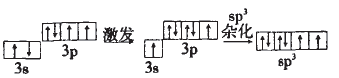
H2SO4为二元强酸,分子中有两个-OH, 在S的sp3的四个轨道上有两个单电子, 有两对成对电子;两个单电子应和-OH中 的O原子分别形成一个σ键,这样还有两个O原子,它们应和S的孤电子对形成配位键,故H2SO4的结构式为:
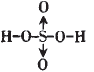 ;
;
HNO3中N的杂化方式与NO3-的应该 一样,NO3-中n=3,故N的杂化方式为sp2。
用轨道表示式可表示如下:
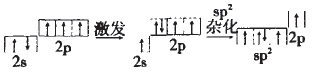
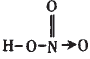
HNO3为一元强酸,分子中有一个-OH, 在N的sp2的三个轨道上有两个单电子, 有一对成对电子;两个单电子中一个应和-OH中的O原子形成一个σ键,另一个与其他O原子形成一个π键;未参与杂化的 2p轨道上的一个单电子与O形成π键;还有一对孤电子应在N和O之间形成配位键。故HNO3的结构式为:

- 全部评论(0)
