工业流程题案例之旧蓄电池处理
时间:2022-08-06 09:53 来源:未知 作者:化学自习室 点击:次 所属专题: 工业流程题案例 蓄电池
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
工业流程综合题型涉及到的化学原理、化学实验操作、化学工业流程评价(利用率、效率、产能、环保)等内容多,集中考察应用所学化学原理、方法解决工业中生产实践问题的能力。主要包括:材料预处理(粉碎、研磨等)、制备(焙烧、浸取、分离、精制等)、实验操作评价、化学过程中化学原理分析等。
解题的关键:明确工业流程的主要思路、熟悉流程涉及物质的主要的化学反应性质、掌握化学实验基础操作的应用范围、特点,掌握化学平衡移动的基本原理;熟知化学反应动力学原理在化学工业中的应用等。
例:废旧铅蓄电池的铅膏中主要含有PbSO4、PbO2、PbO和Pb,以及少量钡、铁、铝的盐或氧化物等。为实现铅资源回收,通过以下流程图实现:
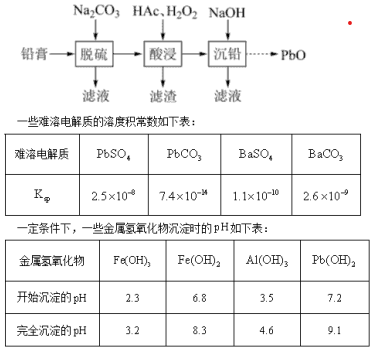
根据以上信息回答问题:
分析:
据题意明确,考察铅废弃物料回收,铅主要存在形态:PbSO4、PbO2、PbO和Pb。含有少量钡、铁、铝的盐或氧化物等杂质。
工业流程的主要思路是将铅物料转化、除杂,获得PbO产品。显然,铅原料价态(0、+2、+4),转化为+2价PbO,反应过程涉及溶解、转化、氧化还原反应等。
工业流程包括铅膏脱硫、酸浸、沉铅、焙烧分解等步骤,进一步分析,
脱硫步骤加入Na2CO3试剂,分离滤液,保留滤渣(沉淀),主要是针对PbSO4转化、分离,实现脱硫,即脱硫酸根,利用溶度积原理,实现PbSO4与Na2CO3反应,生成PbCO3沉淀和Na2SO4溶液,分离,脱硫。
PbSO4(s)+Na2CO3(aq)⇌PbCO3(s)+Na2SO4(aq)
沉淀-溶解平衡:当AgCl沉淀溶解和结晶速度相等时建立一种动态平衡。此时溶液是饱和溶液,它是固液多相平衡。
AgCl(s)⇌Ag+(aq)+Cl-(aq)
Ksp(AgCl) = [Ag+]×[Cl-],
Ksp称为溶度积常数,简称溶度积。它反映了物质生成沉淀、溶解能力。相同类型的难溶电解质比较,Ksp越小的物质,越容易生成沉淀。如,PbSO4与PbCO3比较,Ksp更小的PbCO3易于沉淀,即PbSO4沉淀易于转化为PbCO3沉淀。但是BaSO4与BaCO3比较,两者Ksp相近,无法使BaSO4与碳酸钠反应转化为BaCO3沉淀。PbCO3沉淀中混杂有钡盐杂质。
酸浸步骤,此时铅物料存在形态:PbCO3、PbO2、PbO和Pb,加入HAc、H2O2试剂,控制体系pH值4.9,结合该步骤分离滤渣,保留含铅滤液用于沉铅步骤分析,HAc溶解PbO、PbCO3生成Pb(Ac)2;PbO2具有强的氧化作用(惰性电子对效应),与HAc、H2O2试剂反应,转化为Pb(Ac)2,H2O2起到还原剂作用;Pb(0价)具有一定的还原作用,与HAc、H2O2试剂反应,转化为Pb(Ac)2,H2O2起到氧化剂的作用。涉及反应:
PbCO3+2HAc=Pb(Ac)2+H2O+CO2
PbO+2HAc=Pb(Ac)2+H2O
PbO2+2HAc+H2O2=Pb(Ac)2+2H2O+O2
Pb+2HAc+H2O2=Pb(Ac)2+2H2O
酸浸后,溶液控制体系pH值4.9,此时,并未生成Pb(OH)2沉淀;但铁铝盐杂质生成相应的氢氧化物沉淀,易于与醋酸铅盐溶液分离;为使铁物种更好分离,需要将+2价的亚铁盐转化为+3价的铁盐,显然必然消耗体系中H2O2,整个过程耗用较多的过氧化氢;此时,过氧化氢既是氧化剂、也是还原剂,反应后,并未给体系引入新的杂质。
沉铅步骤,加入NaOH试剂,使得Pb(Ac)2转化为Pb(OH)2沉淀,但引入了钠离子杂质,及钡离子残留;因此,分离后的Pb(OH)2沉淀需要多次洗涤,减少杂质影响。
2NaOH+Pb(Ac)2=Pb(OH)2+2NaAc
沉铅获得的Pb(OH)2沉淀经焙烧分解等处理,得到PbO产品,实现铅膏回收。

- 全部评论(0)
