晨读笔记:氧化还原反应
时间:2023-08-09 15:43 来源:未知 作者:化学自习室 点击: 次 所属专题: 氧化还原反应
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
01.化合价是元素的性质,因此,通常称为元素的化合价而不应称为原子的化合价。
02.不论在离子化合物还是共价化合物中,正负化合价的代数和为零。
03.在单质分子里,元素的化合价为零。
04.有些元素有几种化合价,这是因为这些元素的原子在不同条件下得失电子的数目可以不同,因此生成的不同的化合物中表现出不同的化合价。如氮、硫有多种化合价。
05.化学反应中,反应前后有元素化合价的变化的反应称为氧化还原反应。
06.得失电子看不见,全靠价态来体现。氧化还原反应的本质是电子的转移,特征是化合价的改变。
07.物质所含元素化合价升高的反应叫做氧化反应
08.物质所含元素化合价降低的反应叫做还原反应
09.在化学反应中,一种物质发生氧化反应,必然有一种物质发生还原反应。也就是说,氧化反应和还原反应是在一个反应中同时发生的,这样的反应称为氧化还原反应
10.氧化性是得电子的性质,氧化剂具有氧化性,得电子,价降低;
氧化剂被还原,发生还原反应,对应还原产物。
11.还原性是失电子的性质,还原剂具有还原性,失电子,价升高;
还原剂被氧化,发生氧化反应,对应氧化产物。
12.在氧化还原反应中,一种元素被氧化,不一定有另一种元素被还原(例Cl2+H2O HCl+HClO)
HCl+HClO)
13.双线桥法:表示反应前后同一元素由反应物转化为生成物时电子转移的情况
14.标出反应前后有化合价变化的元素的化合价,明确变价元素的化合价升降关系
15.在反应物到生成物之间画一个线桥,箭头出发和指向的是有化合价变化的同一种元素,一条线始于被氧化的物质中的升价元素止于产物中相应的元素,另一条线始于被还原的物质中的降价元素止于产物中相应的元素
16.在桥上标出“失去”或“得到”的电子总数
17.箭头必须由反应物指向生成物,且两端对准同一种元素
18.在“桥”上标明电子“得到”与“失去”,且得到与失去的电子总数必须相等
19.单线桥法:表示反应过程中不同元素原子间的电子转移情况
20.标出反应前后有化合价变化的元素的化合价,明确变价元素的化合价升降关系
21.单线桥的标注在反应物之间,由失电子的元素,指向得电子的元素。
22.电子的得失可能会出现在同一种物质的同一种原素之间,如H2O2的分解就是从O指向O。
23.箭头方向表明电子转移的方向,“桥”上只标出转移电子的总数,无需注明电子的“得”与“失”
24.置换反应一定是氧化还反应,复分解反应一定不是氧化还原反应
25.有单质参加的化合反应一定是氧化还原反应,有单质生成的分解反应一定是氧化还原反应
26.有单质参加或生成的化学反应不一定是氧化还原反应(例如同素异形体之间的转化)
27.化合反应可能是氧化还原反应:2H2+O2=2H2O、C+O2 CO2
CO2
28.化合反应可能是非氧化还原反应:CaO+CO2=CaCO3、SO3+H2O=H2SO4
29.分解反应可能是氧化还原反应:2H2O=2H2+O2、2HI H2+I2、2H2O2=H2O+O2
H2+I2、2H2O2=H2O+O2
30.可能是非氧化还原反应:CaCO3 CaO+CO2、NH4Cl
CaO+CO2、NH4Cl NH3↑+HCl↑
NH3↑+HCl↑
31.氧化性、还原性的强弱取决于电子得失的难易程度,与电子得失的多少无关。
比如Na、Mg、Al分别可以失去1个电子,2个电子,3个电子,但还原性Na>Mg>Al。
32.Fe与Cl2、S反应,分别失去3个电子,2个电子,此时,可以判断氧化性Cl2>S。
33.元素的最高价只具有氧化性,最低价只具有还原性,处于中间价态既有氧化性又有还原性。
34.元素的化合价处于最高价态时,具有氧化性,但不一定具有强氧化性,如:Na+
35.元素的化合价处于最低价态时,具有还原性,但不一定具有强还原性,如:F-
36.同一种元素不同价态之间发生氧化还原反应时,元素的化合价“只靠近而不交叉”
即:高价要降低,低价要升高,它们最多变为同一价态,不可能发生交叉现象
37.某元素从游离态变为化合态,该元素可能被氧化也可能被还原(2H2S+SO2=3S+2H2O)
38.强氧化剂与强还原剂混合不一定能发生氧化还原反应,如浓硫酸与SO2就不发生反应。
39.常见氧化剂:
①活泼性较强的非金属单质:如Cl2、O2
②变价元素的高价态化合物:如KMnO4、FeCl3、HNO3
③过氧化物:如Na2O2、H2O2
④其他:如HClO、漂白粉、MnO2
40.常见的价态转化形式:
KMnO4→Mn2+、O2→O2-、Cl2→Cl-、Fe3+→Fe2+、H2O2→H2O
41.常见还原剂:
①活泼性较强的金属单质:如Al、Fe、Zn
②某些非金属单质:如H2、S、C等
③含有较低价态元素的化合物:如CO、SO2
④其他:如浓盐酸、NH3
42.常见的价态转化形式:
C→CO/CO2、CO→CO2、H2→H2O、Al→Al3+、Fe→Fe2+、Fe2+→Fe3+、H2S→S/SO2/SO42-、I-→I2。
43.发生溶液中的氧化还原反应而不能大量共存的有
① Fe3+与S2- ② NO3-(H+)与Fe2+③ Fe3+与I-④ ClO-与S2- ⑤ MnO4-(H+)与S2- 、Fe2+、HS-、SO32-、HSO3-等
⑥ Cr2O72-与I-、S2- 、HS-、HSO3-、SO32-等。
44.氧化剂、还原剂的氧化性、还原性强弱比较
①根据方程式判断:氧化剂的氧化性大于氧化产物;还原剂的还原性大于还原产物。
②根据金属活动顺序表:
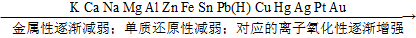
③根据非金属活动顺序表:
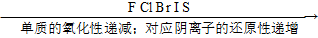
④根据被氧化或被还原的程度
由2Fe + Cl2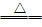 2FeCl3;Fe +
S
2FeCl3;Fe +
S 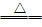 FeS
FeS
可知:氧化性:Cl2 > S
⑤根据反应条件的难易程度:Na与冷水剧烈反应,Mg与冷水几乎不反应,能与热水反应,
Al加热条件下非常缓慢的反应,由上述事实可知,还原性:Na>Mg>Al
⑥根据反应条件的难易程度:
2KMnO4 + 16HCl(浓) = 2KCl + 2MnCl2+5Cl2↑ + 8H2O
MnO2 + 4HCl(浓) MnCl2+Cl2↑ + 2H2O,可知氧化性:KMnO4 > MnO2
MnCl2+Cl2↑ + 2H2O,可知氧化性:KMnO4 > MnO2
另一重要例证就是:非金属单质F2、Cl2、Br2、I2与H2反应:F2与H2暗处剧烈反应并爆炸,Cl2与H2光照剧烈反应并爆炸,Br2与H2加热到500 ℃才能发生反应,I2与H2在不断加热的条件下才缓慢发生反应,且可逆,故氧化性:F2>Cl2>Br2>I2。
⑦某些氧化性或还原性与温度、浓度、酸碱性相关:
a.热的浓硫酸比冷的浓硫酸的氧化性要强,热的浓盐酸比冷的浓盐酸的还原性要强。
b.同一种物质浓度越大,氧化性(或还原性)越强
氧化性:浓HNO3 > 稀HNO3、浓H2SO4>稀H2SO4;还原性:浓HCl>稀HCl
c.同一种物质,所处环境酸(碱)性越强其氧化性(还原性)越强。
例如:中性环境中NO3-不显氧化性,酸性环境中NO3-显氧化性
再如:KMnO4在酸性、中性、碱性条件强,在这三种环境下,得到的还原产生分别为:
Mn2+、MnO2、MnO42-,其氧化性为KMnO4(酸性)>KMnO4(中性)>KMnO4(碱性)
酸性条件:2MnO +6H++5SO
+6H++5SO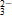 ===2Mn2++5SO
===2Mn2++5SO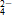 +3H2O
+3H2O
中性条件:2MnO +H2O+3SO
+H2O+3SO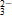 ===2MnO2+3SO
===2MnO2+3SO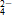 +2OH-
+2OH-
碱性条件:2MnO +2OH-+SO
+2OH-+SO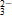 ===2MnO
===2MnO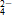 +SO
+SO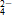 +H2O
+H2O
45.一般情况下,越易失去电子的物质,失电子后越难得电子;
46.越易得电子的物质,得电子后就越难失电子
47.不易失电子的物质不一定易得电子,如:稀有气体,既不易失电子,又不易得电子
48.同一种还原剂遇到多种氧化剂时,若均能反应,则按氧化性由强到弱的顺序依次反应;
例如:如在FeBr2溶液中(还原性Fe2+>Br-)通入Cl2时,Fe2+先与Cl2反应,
再如:如少量Cl2通入到FeI2溶液(还原性I-> Fe2+)中,I-优先反应。
49.同一种氧化剂遇到多种还原剂时,若均能反应,则按还原性由强到弱的顺序依次反应。
例如:在含有Fe3+、Cu2+、H+的溶液中加入Fe粉,先与Fe3+反应,然后依次为Cu2+、H+
50.一般氧化还原反应:指氧化剂和还原剂分别属于不同的物质的氧化还原反应
51.自身氧化还原反应:指氧化剂和还原剂属于同一种物质的氧化还原反应
52.歧化反应:氧化剂和还原剂为同种物质,且发生氧化还原反应的元素均为同种元素之间,这样的氧化还原反应反应称为歧化反应
53.归中反应:氧化产物和还原产物为同种物质,且发生氧化还原反应的元素均为同种元素之间,这样的氧化还原反应反应称为归中反应。或:同种元素由不同价态(高价态和低价态)转变为中间价态的氧化还原反应,称之为归中反应
54.对于部分氧化还原反应,氧化剂(还原剂)中被还原(氧化)与未被还原(氧化)的比例,要依据化学方程式或得失电子数来确定,只有被还原(氧化)的那部分才作氧化剂(还原剂)
在3Cu+8HNO3(稀)= 3Cu(NO3)2+2NO↑+4H2O中,8个HNO3参加反应只有2个HNO3作氧化剂
55.氧化还原方程式的配平依据:电子得失相等,即化合价升降总数相等
56.氧化还原方程式的配平原则:①质量守恒;②得失电子数相等;③离子方程式中电荷守恒
57.氧化还原方程式的配平步骤:列变价,标升降,求总和,配核心,调系数,查守恒。
58.化合反应,分解反应,直接令单一物质的系数为2,4,6等,再据质量守恒即可。
59.歧化反应,由生成物向反应物算升降,再配平,更加容易。
60.缺项配平:先配平含有变价元素的物质的化学计量数,然后由元素守恒确定未知物,再根据质量守恒和电荷守恒进行配平。所缺项不会是氧化剂、还原剂、氧化产物、还原产物。
酸性条件下,缺H(氢)或多O(氧)补H+,少O(氧)补H2O(水)
碱性条件下,缺H(氢)或多O(氧)补H2O(水),少O(氧)补OH-

- 全部评论(0)
