教材分析(必修一):如何学会氧化还原反应
时间:2023-08-08 14:39 来源:未知 作者:张德金 点击: 次 所属专题: 氧化还原反应
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
氧化还原反应的学习难度来自于学生找不到氧化还原规律与感觉的结合,也感觉不到氧化剂的强氧化能力,还原剂的强还原能力。感觉与知识不能结合,只能生记硬背,就会出现学不明白。
要带领学生不断陈述,不断感受,才能慢慢学会。
1、从初中的氧化反应和还原反应入手理解氧化反应和还原反应。
氧化反应:2Cu+O2 2CuO,Cu被氧气氧化为CuO。
2CuO,Cu被氧气氧化为CuO。
还原反应:CuO+H2 Cu+H2O,CuO被氢气还原为Cu。
Cu+H2O,CuO被氢气还原为Cu。
2、利用CuO+H2 Cu+H2O学会更多。
Cu+H2O学会更多。
(1)氧化还原反应:
观察H2反应前后的变化,H2变成H2O。H2被氧化了,H2被氧化为H2O,H2被CuO氧化为H2O。
其实在上面这个反应,CuO被H2还原为Cu,H2被CuO氧化为H2O。既有还原反应,又有氧化反应,这就是氧化还原反应。
(2)氧化剂:有氧化能力的物质。
在2Cu+O2 2CuO中,O2是氧化剂。在CuO+H2
2CuO中,O2是氧化剂。在CuO+H2 Cu+H2O中,CuO是氧化剂。
Cu+H2O中,CuO是氧化剂。
还原剂:有还原能力的物质。在CuO+H2 Cu+H2O中,H2是还原剂。
Cu+H2O中,H2是还原剂。
(3)在CuO+H2 Cu+H2O中,
Cu+H2O中,
还原剂H2被氧化剂CuO氧化为H2O,还原剂被氧化了,发生了氧化反应。
氧化剂CuO被还原剂H2还原为Cu,氧化剂被还原了,发生了还原反应。
(4)氧化产物:发生氧化反应生成的产物。
还原产物:发生还原反应生成的产物。
在CuO+H2 Cu+H2O中,
Cu+H2O中,
氧化剂CuO被还原,发生还原反应,生成Cu。Cu是还原产物。
还原剂H-2被氧化,发生氧化反应,生成H2O。H2O是氧化产物。
(5)规律:
还原剂有还原性,被氧化剂氧化,发生氧化反应,生成氧化产物。
氧化剂有氧化性,被还原剂还原,发生还原反应,生成还原产物。

在CuO+H2 Cu+H2O中,
Cu+H2O中,
H2有还原性,被CuO氧化,发生氧化反应,生成氧化产物H2O。
CuO有氧化性,被H2还原,发生还原反应,生成还原产物Cu。

练习:Fe2O3+3CO 2Fe+3CO2
2Fe+3CO2
3、增加化合价的变化与氧化还原反应的关系。
(1)化合价改变的反应,也是氧化还原反应。分析
CuO+H2 Cu+H2O
Cu+H2O
H2是还原剂,还原剂化合价升高,被氧化,发生氧化反应,生成氧化产物H2O。
CuO是氧化剂,氧化剂化合价降低,被还原,发生还原反应,生成还原产物Cu。
(2)再分析
Fe+H2SO4= FeSO4+H2↑
Fe化合价升高,是还原剂,被氧化,发生氧化反应,生成氧化产物FeSO4。
H2SO4化合价降低,是氧化剂,被还原,发生还原反应,生成还原产物H2。
练习:Cu+2FeCl3= CuCl2+2FeCl2
4、增加得失电子与氧化还原反应的关系。
(1)化合价的变化与电子的得失有关。
化合价升高是因为失去电子,化合价降低是因为得到电子。分析
2Na+Cl2 2NaCl
2NaCl
Na失去电子,化合价升高,被氧化,发生氧化反应。
Cl2得到电子,化合价降低,被还原,发生还原反应。
(2)再分析:
Zn+Cu2+= Zn2++Cu
Zn失去电子,化合价升高,被氧化,发生氧化反应。
Cu2+得到电子,化合价降低,被还原,发生还原反应。
练习:Mg+Br2 MgBr2
MgBr2
5、增加电子对的偏移与氧化还原反应的关系。
化合价的变化还与共用电子对的偏移有关。
(1)什么是共用电子对?在多原子分子的非金属单质或化合物中,存在于原子与原子之间的电子对,叫共用电子对,它能形成一种力量,使原子和原子连结在一起。
(2)什么是共用电子对的偏移?
若共用电子对偏离于一个原子,偏向于另一个原子,则原子会显正负价态。
如HCl气体分子中,H和Cl之间有一对共用电子对,并且共用电子对偏向于Cl,H :Cl,所以H显+1价,Cl显-1价。
(3)H2+Cl2 2HCl
2HCl
在上面这个反应中,不能陈述为H2失去电子,Cl2得到电子。只能陈述为H2化合价升高,被氧化,发生氧化反应。Cl2化合价降低,被还原,发生还原反应。
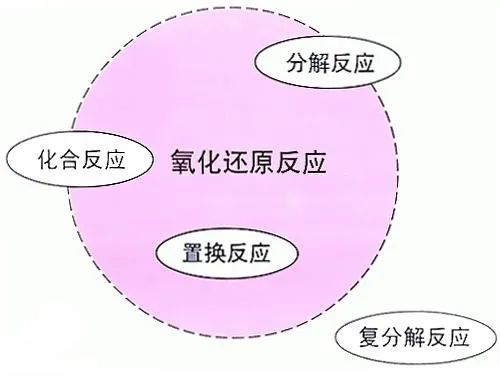
6、学会用举例法找到四大反应类型与氧化还原反应之间的关系
(1)化合反应:
H2+Cl2 2HCl是氧化还原反应。
2HCl是氧化还原反应。
CaO+H2O=Ca(OH)2不是氧化还原反应。
(2)分解反应:
2H2O  2H2↑+O2↑是氧化还原反应。
2H2↑+O2↑是氧化还原反应。
CaCO3 CaO+CO2↑不是氧化还原反应。
CaO+CO2↑不是氧化还原反应。
(3)置换反应:
Fe+H2SO4= FeSO4+H2↑是氧化还原反应。
Zn+CuCl2= ZnCl2+Cu是氧化还原反应。
没有发现不是氧化还原反应的置换反应。
(4)复分解反应:
NaOH+HCl= NaCl+ H2O不是氧化还原反应。
CaCl2+Na2CO3=CaCO3↓+2NaCl不是氧化还原反应。
没有发现是氧化还原反应的复分解反应。
所以,氧化还原反应与四个反应类型的关系是:
7、学会双线桥法与单线桥法。
双线桥法和单线桥法,都是分析氧化还原反应的方法。
(1)双线桥法表示了还原剂到氧化产物和氧化剂到还原产物的电子转移、化学升降、被氧化或被还原等一些变化。

双线桥上内容的多少与书写要求有关。2×e‑中2指化合价发生改变的H原子数目,E‑指一个H化合价改变时转移的电子数。
箭头的起点和终点要指向化合价改变的元素。
(2)单线桥法表示了还原剂到氧化剂的电子转移情况。
![]()
箭头的起点指向化合价升高的元素,终点要指向化合价降低的元素。
不能写失去或得到电子,不能写化合价升高或降低等。电子只写总数,不能写成2×E‑这种形式。
8、学会分析化合物中元素的价态
(1)KMnO4中Mn的价态推理:
用O的化合价为-2,K的化合价为+1,推理出Mn的化合价为+7。
(2)金属元素的价态:
金属活动顺序表中,只有Fe和Cu显示多种价态。Fe常见有+2、+3,不常见有+6。Cu常见有+2、+1。
(3)非金属元素的价态:
只有F有唯一价态-1。
H常见有+1,不常见有-1(在金属氢化物中,如NaH)
O常见有-2、-1(Na2O2和H2O2等过氧化物中)。
其它元素见下表
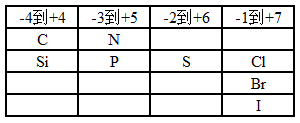
所以C、N、Si、P、S、Cl、Br、I等元素的价态一般要靠其它元素的常见价态进行推理。
如氯的价态:ClO2(+4)、KClO3(+5)、NaClO(+1)。
9、学会一些常见的氧化剂和还原剂。
介绍一下每种氧化剂和还原剂的常见性质及它们的产物形态,能使学生更容易记住这些氧化剂、还原剂及它们的氧化还原能力。
(1)常见的氧化剂:这是一些具有很强的氧化能力的物质。很多物质在碰到它们后会被氧化。
①单质:O2、Cl2。
O2是自然界中最常见的氧化剂,很多物质会在它的氧化作用下,慢慢被氧化。氧化之后O的价态为-2。
Cl2是一战时有名的毒气,经常显示出比氧气更强的氧化能力。氧化之后Cl的价态为-1。
例如,Cu+Cl2 CuCl2
CuCl2
②化合物:浓硫酸、硝酸、KMnO4、FeCl3等。
浓硫酸:稀盐酸、稀硫酸不能溶解Cu,热的浓硫酸能溶解Cu,有强氧化性。浓硫酸的氧化能力比稀硫酸更强,且氧化能力不是来自于元素H,而是元素S,反应产物为SO2。Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
硝酸:不论浓硝酸还是稀硝酸,都能溶解Cu,有强氧化性。硝酸的氧化能力氧化能力来自于元素N。浓硝酸的反应产物为NO2,稀硝酸的反应产物一般为NO。Cu+4HNO3(浓) Cu(NO3)2+2NO2↑+2H2O,3Cu+8HNO3(稀)
Cu(NO3)2+2NO2↑+2H2O,3Cu+8HNO3(稀) 3Cu(NO3)2+2NO↑+4H2O
3Cu(NO3)2+2NO↑+4H2O
KMnO4:有强氧化性,氧化能力来自于元素Mn,一般与稀酸混合使用,反应产物为Mn2+盐。2KMnO4+16HCl=2MnCl2+5Cl2↑+2KCl+8H2O
FeCl3:Fe3+的盐都有强氧化性,如Fe2(SO4)3、Fe(NO3)3,氧化能力来自于Fe3+,反应产物一般为Fe2+。能溶解Cu。Cu+2FeCl3=CuCl2+2FeCl2
(2)常见的还原剂:这是一些有很强的还原能力的物质。碰到氧化剂时,很容易被氧化。
①单质:包括较活泼的金属和以还原性为主的非金属。
较活泼的金属,反应产物为金属阳离子。如2Fe+3Cl2 2FeCl3
2FeCl3
以还原性为主的非金属,如H2、C。
②化合物:CO、Na2S、SO2或Na2SO3、KI、FeCl2等。
CO:在高温下能还原一些金属氧化物,生成CO2。Fe2O3+3CO 2Fe+3CO2
2Fe+3CO2
Na2S:-2价的S有很强的还原性,在水溶液中易被氧化为单质S。Na2S+Cl2=2NaCl+S↓
SO2或Na2SO3:+4价的S有很强的还原性,在水溶液中易被氧化为SO42-。2SO2+O2+2H2O=2H2SO4,2Na2SO3+O2=2Na2SO4
KI:-1价的I有很强的还原性,在水溶液中易被氧化为单质I2。2KI+Cl2=2NaCl+I2
FeCl2:Fe2+有较强的还原性,在水溶液中易被氧化为Fe3+。2FeCl2+Cl2=2FeCl3
10、学会简单的氧化还原反应的配平方法。
(1)什么是电子守恒?
这是氧化还原反应中的一个规律。在一个配平的氧化还原反应中,氧化剂的得电子总数与还原剂的失电子总数相等。
(2)对于用质量守恒不容易配平的氧化还原反应:
先利用电子守恒,再利用质量守恒。
如SO2+HNO3+H2O=H2SO4+NO
先分析SO2失去2e-,HNO3得到3e-,利用电子守恒,
配得:3SO2+2HNO3+H2O=H2SO4+NO
再利用质量守恒,配得:3SO2+2HNO3+2H2O=3H2SO4+2NO
练习:Na2SO3+HNO3=Na2SO4+NO↑+H2O
11、学会比较物质的氧化性和还原性。
(1)根据金属活动性顺序,知道Zn的活泼性大于Cu,其实就是Zn的还原性大于Cu。
在Zn+CuCl2= ZnCl2+Cu中,Zn是还原剂,Cu是还原产物,得到结论:还原剂的还原性大于还原产物的还原性,还原剂的还原性在整个反应的所有物质中是最强的。
同样,氧化剂的氧化性在整个反应的所有物质中也是最强的。氧化剂的氧化性大于氧化产物的氧化性。
在Cl2+2KI=2KCl+I2中,Cl2是氧化剂,I2是氧化产物,Cl2的氧化性大于I2的氧化性。
练习:
在Fe+H2SO4= FeSO4+H2↑中, 的还原性大于 的还原性。
在2FeCl2+Cl2=2FeCl3中, 的氧化性大于 的氧化性。
12、尝试学习推测物质的强氧化性或强还原性及它们的产物可能。
琢磨每种元素在自然界中的常见价态,这种价态也是该元素的稳定价态,稳定价态一般没有强氧化性或强还原性。
如果物质中的某元素的价态很难见到,那么该元素就有比较强烈地趋向于生成稳定价态的可能,这种物质可能会有强氧化性或强还原性。
(1)例如O,在自然界中的常见价态是-2和0。
H2O2中的O的价态为-1,这种价态在自然界中很难看到。所以H2O2有趋向于生成0或-2的可能,具有强还原性和强氧化性。
H2O2不稳定,自身能发生分解反应。遇SO2等强还原剂显示强氧化性。遇酸性KMnO4等强氧化剂显示强还原性。
(2)例如Cl,在自然界中的常见价态是-1。
Cl2中的Cl的价态为0,这种价态在自然界中很难看到。所以Cl2有趋向于生成Cl-的可能,具有强氧化性。
NaClO中的Cl的价态为+1,这种价态在自然界中也很难看到。所以NaClO有趋向于生成Cl-的可能,具有强氧化性。
(3)例如S,在自然界中的常见价态是+6的SO42-和0的S。
Na2S中的S的价态为-2,这种价态在自然界中不常见。所以Na2S有趋向于生成S的可能,具有强还原性。
SO2中的S的价态为+4,这种价态在自然界中也不常见。所以SO2有趋向于生成SO42-的可能,具有强还原性。

- 全部评论(0)
