晨读笔记:硫及其化合物
时间:2023-08-09 19:53 来源:未知 作者:化学自习室 点击: 次 所属专题: 硫及其化合物
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
01.硫元素在自然界中既有游离态,也有化合态。
02.游离态的硫主要存在于火山喷发口,而化合态主要以硫化物、硫酸盐的形式存在。
如硫铁矿(FeS2)、黄铜矿(CuFeS2)等,石膏(CaSO4·2H2O)、芒硝(Na2SO4·10H2O)等。
03.硫是淡黄色固体,难溶于水,微溶于酒精,易溶于CS2。S单质其实并不是一个S原子构成的,而是Sx的形式存在,比如S8,故S单质为非极性分子,而CS2与CO2的结构相同,O=C=O,S=C=S,故CS2是直线形的非极性分子,根据相似相溶原理中非极性分子易溶于非极性溶剂可知,S单质易溶于CS2是可能的,由于酒精是极性溶剂,故CS2微溶于酒精。
04.附着于试管内壁的硫,可以用热的NaOH溶液进行洗涤,也可以用CS2进行洗涤。
3S +6NaOH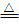 2Na2S+Na2SO3+3H2O
2Na2S+Na2SO3+3H2O
05.硫在氧气中的燃烧产物只能是SO2,即使氧气过量,也不能生成SO3。如果在潮湿的环境中,或有粉法催化的情况下,SO2也能被O2氧化成H2SO4或SO3。
06.硫可以与金属反应,硫与变价金属反应时,只能生成低价金属硫化物。
①硫粉与钠研磨爆炸:2Na+S===Na2S
②硫与铝共热:2Al+3S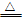 Al2S3 (制取Al2S3的唯一途径)
Al2S3 (制取Al2S3的唯一途径)
③铁与硫粉共热:Fe+S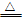 FeS (黑色固体,不溶于水,FeS是低价硫化物)
FeS (黑色固体,不溶于水,FeS是低价硫化物)
④铜与硫粉共热:2Cu+S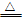 Cu2S (黑色固体,不溶于水,Cu2S是低价硫化物)
Cu2S (黑色固体,不溶于水,Cu2S是低价硫化物)
⑤硫与银反应:2Ag+S===Ag2S (银器变黑)
⑥硫与汞反应:Hg+S===HgS (汞蒸气有毒,实验室里不慎洒落一些汞,可撒上硫粉进行处理)
07.硫单质呈0价,处于硫元素的中间价态,硫有氧化性又有还原性。
S+O2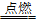 SO2,S+2H2SO4(浓)
SO2,S+2H2SO4(浓)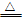 3SO2+2H2O,S+6HNO3(浓)
3SO2+2H2O,S+6HNO3(浓)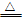 H2SO4+6NO2↑+2H2O
H2SO4+6NO2↑+2H2O
上述反应均体现了S的还原性;
H2+S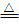 H2S,体现了S的氧化性;
H2S,体现了S的氧化性;
3S +6NaOH 2Na2S+Na2SO3+3H2O 体现了S的氧化性和还原性
2Na2S+Na2SO3+3H2O 体现了S的氧化性和还原性
08.S用于制造硫酸、硫化橡胶,也用于制药和黑火药(S+2KNO3+3C K2S+3CO2↑+N2↑)
K2S+3CO2↑+N2↑)
09.二氧化硫易溶于水,溶解度为1:40,生成亚硫酸(该反应可逆),亚硫酸为中强酸。
10.二氧化硫中含有少量的HCl可以通过饱和的NaHSO3除去。
NaHSO3+HCl=NaCl+SO2↑+H2O本质上是利酸性:HCl>H2SO3
11.CO2含有少量的SO2可以通过饱和的NaHCO3除去。
2NaHCO3+SO2=Na2SO3+2CO2↑+H2O本质上是利酸性:H2SO3>H2CO3
12.二氧化硫有酸性氧化物,氧化性、还原性、漂白性四方面性质。
13.SO2不能漂白酸碱指示剂,能使紫色石蕊溶液变红,但不能褪色。
14.SO2具有漂白性,能使品红溶液褪色,但加热后又恢复到原来的颜色,SO2与有色物质生成了不稳定的无色物质,加热后又复原,其漂白具有可逆转性。
15.SO2使氯水、溴水、酸性KMnO4溶液褪色,是因为发生了氧化还原反应,体现了SO2的还原性。
16.SO2使氯水褪色,是因为发生了如下反应:Cl2+SO2+2H2O===2HCl+H2SO4。
17.SO2使溴水褪色,是因为发生了如下反应:Br2+SO2+2H2O===2HBr+H2SO4。
18.SO2使酸性KMnO4溶液褪色,反应为:5SO2+2MnO4-+2H2O===5SO42-+2Mn2++4H+。
19.SO2使氯水、溴水、酸性KMnO4溶液褪色,此过程不是漂白,漂白是指有机物褪色的过程。
20.SO2与Fe3+反应:SO2+2Fe3++2H2O===SO42-+2Fe2++4H+
21.SO2与Fe3+反应这一过程,不是褪色的过程,而是颜色变浅,因为Fe2+为浅绿色。
22.SO2与稀HNO3反应的离子方程式:3SO2+2NO3-+2H2O===3SO42-+2NO↑+4H+
23.SO2与H2O2反应:SO2+H2O2===H2SO4
24.SO2与Na2O2反应:SO2+Na2O2===Na2SO4
25.SO2通入H2S溶液中会生成淡黄色浑浊S,体现了SO2的氧化性。
26.SO2与BaCl2溶液不反应,若发生反应,则相当于由H2SO3制备得到了HCl,不符合以强制弱。
27.SO2通入BaCl2溶液中无明显现象,若再通入NH3,则生成BaSO3沉淀。
28.SO2通入BaCl2溶液中无明显现象,若再通入Cl2/O2/NO2等氧化性气体,则生成BaSO4沉淀。
29.SO2通入BaCl2溶液中无明显现象,若加入KNO3固体,则生成BaSO4沉淀。
30.SO2通入BaCl2溶液中无明显现象,若加入氯水,则生成BaSO4沉淀。
31.SO2通入BaCl2溶液中无明显现象,若通入H2S,则生成S沉淀。
32.含硫化石燃料,燃烧会产生SO2,因此燃煤必须脱硫,即“钙基固硫”。
CaO+SO2===CaSO3,CaSO3+O2 2CaSO4
2CaSO4
33.加入CaO脱硫,只能减少SO2的排放,不会减少CO2的排放。
34.正常雨水的pH为5.6,pH小于5.6的雨水是酸雨。
硫酸型酸雨放置后,酸性会增强,溶液中的H2SO3被O2氧化成H2SO4而使酸性增强。
35.二氧化硫可用于漂白纸浆、毛、丝、草帽辫等;用于杀菌消毒。
36.食品中添加适量的SO2可以起到漂白、防腐和抗氧化等作用。例如,在葡萄酒酿制过程中,葡萄汁中某些细菌的繁殖会影响发酵,添加适量的SO2可以起到杀菌的作用。SO2又是一种抗氧化剂,能防止葡萄酒中的一些成分被氧化,起到保质作用,并有助于保持葡萄酒的天然果香味,故葡萄酒,开启后有醒酒的过程,就是让SO2充分氧化,以获得更好的口感和健康品质。
37.SO2是可以作食品添加剂的,中国规定可用于葡萄酒和果酒,最大使用量0.25g/kg,残留量不得超过0.05g/kg,超过限定值将会危害人体健康
38.SO2实验室制备时,用到的是Na2SO3固体+70%的浓H2SO4,硫酸浓度太大,硫酸提供的氢离子浓度反而变小,不利于反应的进行;硫酸浓度太小,不利于生成的SO2逸出。
Na2SO3+H2SO4===Na2SO4+SO2↑+H2O
39.工业上,富硫国家生产二氧化硫的反应为:S+O2 SO2
SO2
40.工业上,还可以用金属硫化物生产二氧化硫:4FeS2+11O2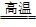 2Fe2O3+8SO2
2Fe2O3+8SO2
41.SO3是无色易挥发的固体(熔点16.8℃,沸点44.8℃),标准状况下是固体。
42.SO3是硫酸的酸酐,具有酸性氧化物的通性。
43.SO3能强烈的吸水,与水剧烈反应生成H2SO4,同时放出大量热,形成酸雾。
44.工业上吸收生成的SO3,用浓硫酸吸收,形成“发酸硫酸”(H2SO4·SO3)。
45.浓硫酸的性质体现在酸性、难挥发性、吸水性、脱水性和强氧化性。
46.浓硫酸具有吸水性,常用作干燥剂,但不能干燥碱性气体NH3和还原性气体H2S、HBr、HI等。
47.浓硫酸与H2S可以发生如下反应:H2S+H2SO4(浓)===S↓+SO2↑+2H2O
48.浓硫酸的脱水性是将有机物中的氢、氧元素按照原子个数为2:1的比例脱去生成水。
49.浓硫酸是高沸点酸,难挥发,利用此性质可制备HCl,原理为2NaCl+H2SO4 Na2 SO4+2HCl↑。
Na2 SO4+2HCl↑。
50.浓硫酸的稀释方法:将浓H2SO4沿器壁慢慢注入水中,并用玻璃棒搅拌。
51.浓硫酸能与活泼金属Fe、Al在常温下钝化,钝化也是化学变化,只是现象不明显。
52.常温下可以用铁、铝制容器来盛装浓硫酸,比如用铁槽车业运输浓硫酸。
53.破坏钝化,可以采用加热或使浓溶液变稀的方法实现。
54.加热时,铁与浓硫酸可以反应:2Fe+6H2SO4(浓)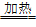 Fe2(SO4)3+3SO2↑+6H2O
Fe2(SO4)3+3SO2↑+6H2O
55.浓硫酸能与除Au,Pt外的所有金属在加热条件下反应。
56.浓硫酸与Cu反应,随着反应的进行,浓硫酸会变稀,反应停止。
57.1 mol Cu与含2 mol H2SO4的浓硫酸充分反应,生成的SO2的物质的量小于1 mol。
58.Cu与浓硫酸的反应中,浓H2SO4的作用:强氧化性和酸性,如果产物中出现了硫酸盐,则体现了硫酸的酸性。
59.检验Cu与浓硫酸的反应后溶液里有CuSO4的方法是:将反应后的混合液慢慢注入盛水的烧杯中,若溶液为蓝色,则证明有CuSO4存在,不能将水加入待测液中,因为待测液中有浓硫酸。
60.浓硫酸与Zn反应,开始产生SO2,硫酸变稀后,产生的气体为H2,若Zn无剩余,则气体总量不受硫酸浓稀的影响。Zn+2H2SO4(浓)==ZnSO4+SO2↑+2H2O,Zn+H2SO4(稀)==ZnSO4+H2↑
61.黑面包实验中,蔗糖被浓H2SO4脱水生成C,体现了浓H2SO4的脱水性;然后与C反应产生的CO2和SO2,体现强氧化性,但没有体现酸性,C+2H2SO4(浓) CO2↑+2SO2↑+2H2O。
CO2↑+2SO2↑+2H2O。
62.浓硫酸与木炭反应产物的检验过程,应依次通过CuSO4粉末,品红,酸性KMnO4,品红,Ca(OH)2溶液,检验CO2时,若品红(后)溶液不褪色,且澄清石灰水变浑浊,可以判断CO2的存在。
63.上述实验中,检验SO2的存在用品红溶液,吸收SO2则需要用到酸性KMnO4溶液,此时不能用NaOH来吸收SO2的原因是NAOH也会吸收CO2,对后续检验产生干扰;另外第二支试管中的品红不褪色,确认SO2已除尽,才能根据沉淀来确认CO2的存在。
64.若实验室没有品红,用极稀的酸性KMnO4溶液,稀溴水,都能代替品红检验SO2的存在与否。
65.浓硫酸与硫的反应:S+2H2SO4(浓) 3SO2↑+2H2O
3SO2↑+2H2O
66.浓硫酸与红磷反应:2P+5H2SO4(浓) 2H3PO4+5SO2↑+2H2O
2H3PO4+5SO2↑+2H2O
67.浓硫酸可将碳、磷等非金属单质氧化成高价态的氧化物或含氧酸,本身被还原为SO2
68.SO42-的检验方法:待测液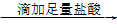 无明显现象
无明显现象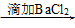 有白色沉淀生成。
有白色沉淀生成。
69.SO42-的检验先加稀盐酸的目的是防止CO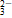 、SO
、SO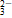 、Ag+干扰,先加入盐酸无明显变化,后面再加入BaCl2溶液,生成沉淀,则可知沉淀是由Ba2+引起的,加入盐酸,将CO
、Ag+干扰,先加入盐酸无明显变化,后面再加入BaCl2溶液,生成沉淀,则可知沉淀是由Ba2+引起的,加入盐酸,将CO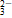 、SO
、SO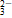 已排除,故此时生成的沉淀只有BaSO4,故原溶液中有SO42−。
已排除,故此时生成的沉淀只有BaSO4,故原溶液中有SO42−。
70.SO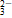 的检验:被检液
的检验:被检液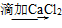 沉淀
沉淀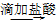 气体
气体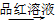 品红溶液褪色,说明含SO
品红溶液褪色,说明含SO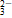 。
。
涉及反应:SO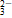 +Ca2+===BaSO3↓;CaSO3+2H+===Ca2++SO2↑+H2O
+Ca2+===BaSO3↓;CaSO3+2H+===Ca2++SO2↑+H2O
操作方法:取少量待测液于试管中,加入CaCl2溶液,若生成白色沉淀,再加入稀盐酸,将产生的气体通入品红溶液,若红色褪去,则含有SO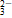 。
。

- 全部评论(0)
