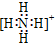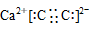晨读笔记:化学键
时间:2023-08-09 16:49 来源:未知 作者:化学自习室 点击: 次 所属专题: 化学键
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
01.相邻微粒间的强烈相互作用称为化学键。
02.阴阳离子通过静电作用形成离子键,静电作用包含静电引力和静电斥力。
03.有离子键的化合物一定是离子化合物,离子化合物中一定有离子键,可能有共价键,如NaOH。
04.原子间通过共用电子对形成的相互作用称为共价键。
05.共价键成键本质是共用电子对与成键原子间的静电作用。
06.不同元素的原子间形式的共价键,共用电子对会偏向非金属性强的一方,为非极性共价键。
07.同种元素的原子间形式的共价键,共用电子对不偏向任何一方,为非极性共价键。
08.稀有气体内部不存在化学键,因为它是单原子分子,微粒间存在的分子间的作用力。
09.稀有气体也是由分子构成的,只不过这种分子比较特殊,是由一个原子构成的。
10.以共用电子对形成分子的化合物称为共价化合物
11.常见的共价化合的类别为:非金属氢化物:如NH3、H2S、H2O等;非金属氧化物:如CO、CO2、SO2等;酸:如H2SO4、HNO3等;大多数有机化合物:如CH4、CH3CH2OH等.
12.共价化合物中只含有共价键,没有离子键。
13.含有共价键的物质不一定是共价化合物,如N2,Cl2等是单质,NaOH,Na2O2等是离子化合物。
14.离子化合物不一定有金属元素如NH4Cl,共价化合物中可以有金属元素,如AlCl3、HMnO4。
15.只含非金属元素的化合物不一定是共价化合物,例如铵盐NH4Cl,NH4CO3是离子化合物。
16.离子晶体熔化破坏离子键,原子晶体熔化破坏共价键,分子晶体熔化破坏分子间的作用力。
17.判断一种化合是离子化合物还是共价化合物,若其熔融状态下能导电,则为离子化合物。
18.液态HCl不导电,因为它存在的粒子是HCl分子,而HCl溶于水,会发生电离而导电。
19.离子化合物溶于水时,不一定会导电,比如某些离子化合物溶解度很小。
20.共价化合物溶于水时,部分导电,如HCl的水溶液;部分不导电,如乙醇的水溶液。
21.分子间存在一种把分子聚集在一起的作用力,叫做分子间作用力,又称范德华力。
22.由分子构成的物质,其熔点、沸点等物理性质主要由分子间作用力大小决定。
23.分子间的作用力越大,破坏起来越困难,溶沸点越高,熔化、气化没有破坏分子内的共价键。
24.氢键是极性较强的N、O、F的氢化物间易形成一种作用,强于普通分子间作用力。
25.氢键不是化学键,氢键是一种较强的分子间作用力,氢键比化学键弱,比范德华力强。
26.分子间形成的氢键,分子间的作用会增强,会使物质的熔点和沸点升高。
27.水结冰时,水分子间形成的氢键构成了一些空腔,而使水的体积变大,即密度变小,温度升高,氢键会遭到破坏,故水在4℃时,密度最大。
28.在一些复杂的分子里,也可以形成分子内氢键,分子内氢键的存在,使得分子间的作用变弱,溶沸点降低,分子的氢键,使物质的溶沸点升高。
29.对于组成结构相似的物质,若分子无氢键形成,则相对分子质量越大,分之间作用力越大,熔沸点越高,CH4<SiH4(硅烷)。
30.分子间氢键的存在使物质的熔沸点升高。H2O>H2S<H2Se,HF>HCl<HBr<HI,NH3>PH3<AsH3
31.化学反应的本质是旧化学键的断裂和新化学键的形成。
32.有化学键断裂的不一定是化学变化,如HCl、NaCl溶于水;有旧键的断裂,但无新键的生成。
33.在元素符号周围用“·”或“×”来表示原子的最外层电子(价电子)的式子叫做电子式。
34.简单阳离子的电子式就是其离子符号,例如:Na+、Li+、Mg2+、Al3+等。
35.复杂阳离子,把带上括号带上电荷,如: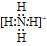
36.阴离子都是,写上电子,带上括号,标明电荷,如: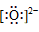 、
、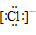 、[
、[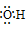 ]—、
]—、
37.在化合物中,如果有多个阴、阳离子,阴、阳离子必须是间隔的,即不能将两个阴离子或两个阳离子写在一起。常见的物质的电子式如下:
| H2 | H | Cl2 |
| N2 |
|
H2O |
| HClO |
| CO2 |
|
CH4 |
| CCl4 |
| C2H6 |
|
C2H4 |
| C2H2 |
| BF3 |
|
NH3 |
| N2H4 |
| H3O+ |
|
H− |
| Cl− |
| O2− | Na+ |
OH− | [ | NaOH | Na+[ | Ba(OH)2 | [ |
H2O2 |
| Na2O2 |
| NaF | Na+[ |
MgCl2 | [ | NH4Cl |
| CaC2 |
|
38.用电子式表示化合物形成过程时,由于不是化学方程式,不能出现“===”。
39.用电子式表示化合物形成过程时,“→”前是原子的电子式,“―→”后是化合物或单质的电子式。
40.用电子式表示化合物形成过程时,如果生成离子化合物,还需要提示出电子的得失过程。

- 全部评论(0)
 H
H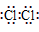
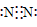
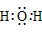
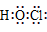
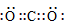
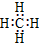
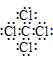
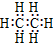
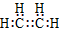
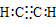
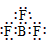
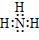
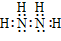
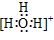
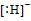

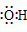 ]−
]−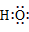 ]− Ba2+[
]− Ba2+[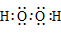
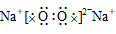
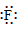 ]−
]−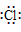 ]−Mg2+[
]−Mg2+[