教材分析(必修一):原子结构与元素周期表
时间:2023-08-08 15:46 来源:未知 作者:张德金 点击: 次 所属专题: 原子结构 元素周期表
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、原子结构
1、原子的构成
由原子核(质子+中子)、核外电子构成。
1个质子带1个正电荷,1个电子带1个负电荷,中子不带电荷。
原子核内的质子数与原子核外的电子数相等,整个原子不带电荷。
2、质子数、中子数、质量数的关系
(1)什么是质量数:原子核内质子数和中子数的数目之和,符号为A。
质子数的符号为Z,中子数的符号为N。
质子数(Z)+中子数(N)=质量数(A)
质子数=核电荷数=原子的核外电子数=原子序数
(2)用质量数表示粒子
①23592U,表示元素铀的原子,左上角的235表示质量数,左下角的92表示质子数。
此原子的中子数为235-92=143
②18O22-,表示元素氧的双原子阴离子,右上角的2-表示此离子带2个负电荷,右下角的2表示此离子由2个原子组成。
此离子的质量数为18×2=36
此离子的质子数为8×2=16
此离子的中子数为36-16=20
此离子的电子数为8×2+2=18
3、电子层:电子在能量不同的区域内运动,简化为不连续的壳层,叫电子层。
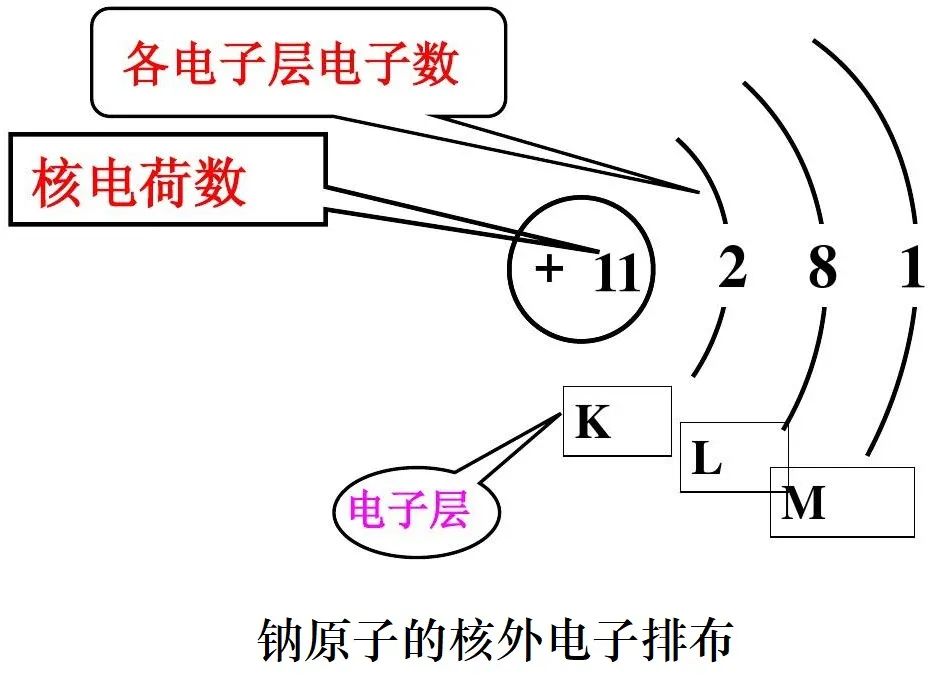
(1)电子层从内向外用n=1,2,3,4,5,6,7……或K、L、M、N、O、P、Q……来表示。
(2)不同层的电子的能量是不同的。内层上的电子的能量低,外层上的电子的能量高。
(3)电子先从内层填充,充满后再填充外一层。
【问题】每一层上最多能填充多少个电子?
根据稀有气体元素原子的电子层排布表分析
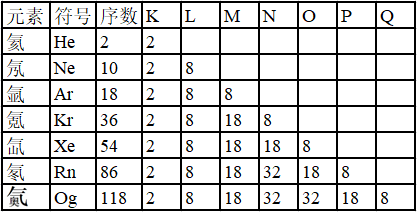
(1)第n层上最多容纳2n2个电子。
(2)最外层最多容纳8个电子(K为最外层时最多容纳2个电子)
(3)次外层最多容纳18个电子,倒数第三层最多容纳32个电子。
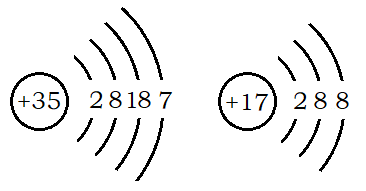
练习:画出Br、Cl-的原子结构示意图。
二、元素周期表
1、1869年俄国化学家门捷列夫将元素按照相对原子质量从小到大依次排列,并把化学性质相似的元素放在一个纵列,制出了第一张元素周期表。
2、在元素周期表中
原子序数=核电荷数=质子数=核外电子数
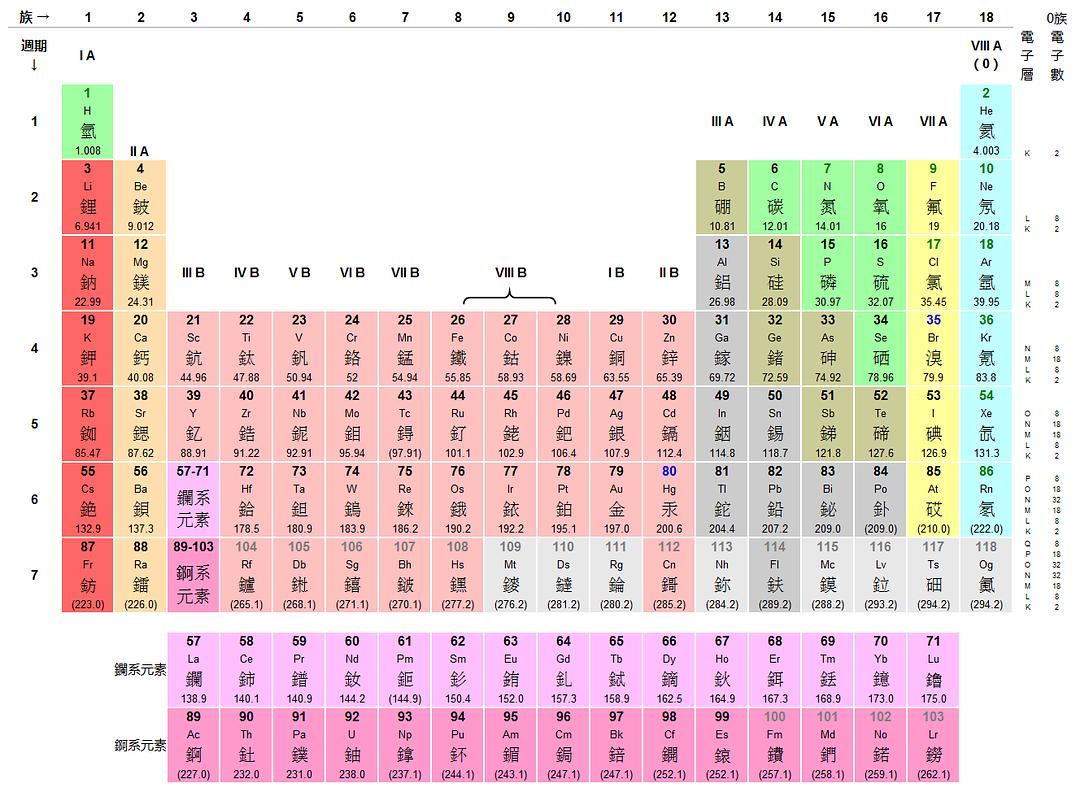
3、研究元素周期表的结构:
(1)横行:有7行。1个横行叫1个周期,共有7个周期。
每个周期的元素数目:
第一周期:2个。
第二周期和第三周期:8个。
第四周期和第五周期:18个。
第六周期和第七周期:32个。
短周期:第一、二、三周期。
长周期:第四、五、六、七周期。
(2)纵行:有18列。1个纵列叫1个族(8,9,10三个纵列共同组成第VII族),共有16个族。画出各族的位置
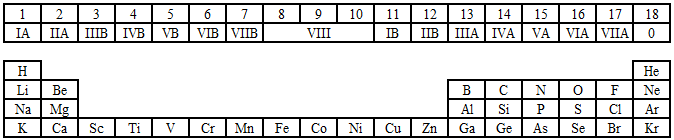
主族:带A的族,共有7个主族,分别为IA族-VIA族,分布在第1、2、13、14-17列。
副族:带B的族和VII族,共有8个副族。IB族-VIB族,分布在第11、12、3、4-7列。
VII族:分布在第8、9、10列。
0族:分布在第18列。包括稀有气体He、Ne、Ar、Kr、Xe、Rn、Og。
元素最多的一列:第三列,有32个元素。
4、同周期元素的原子在结构上的相似点?同主族元素的原子在结构上的相似点?
同周期元素的原子的核外电子层数相同。
同主族元素的原子的最外电子数相同。
5、元素在元素周期表中的位置的表示方法
(1)氧:第二周期第VIa族。
(2)锰:第四周期第VIb族。
(3)铁:第四周期第VII族。
(4)氩:第三周期第0族。
6、碱金属元素和卤族元素
(1)碱金属元素:IA族中除H之外的元素,包括Li(锂)、Na(钠)、K(钾)、Rb(铷)、Cs(铯)、Fr(钫)
(2)卤族元素:VIA族元素,包括F(氟)、Cl(氯)、Br(溴)、I(碘)、At(砹)、Ts(“石田”)
7、需要熟练掌握前20号元素中每个元素的原子序数,在元素周期表中的位置,核外电子排布。
例如,O是8号元素,在第二周期VIA族,最外层电子数是次外层电子数的三倍。
Si是14号元素,在第三周期IVA族,最外层电子数是次外层电子数的一半。
8、主族元素的最高正价态或最低负价态与最外层电子数有关,也能提示它在哪一主族。
最高正价态=最外层电子数
最低负价态=最外层电子数-8
例如,C的最高正价态是+4,C的最外层有4个电子,它在IVA族。
Cl的最低负价态是-1,Cl的最外层有7个电子,它在VIA族。
三、核素
1、什么是核素?
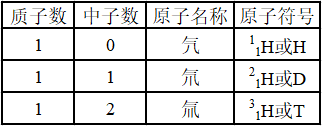
具有一定数目质子和一定数目中子的一种原子。如11H、21H、31H,是氢元素的三种核素,它们是氢元素的三种不同的原子。
(1)元素与核素的区别是,元素是具有相同质子数的一类原子的总称。
(2)同位素:质子数相同而中子数不同的同一元素的不同原子互称同位素。
天然存在的同位素,相互保持一定的比率。
(3)元素的相对原子质量的计算
用该元素各种核素所占的一定百分比计算出平均值。
例如,氯在自然界中有两种同位素35Cl、37Cl,35Cl的相对原子质量是34.969,37Cl的相对原子质量是36.966,这两种氯原子在自然界所占的原子个数百分比分别是75.77%和24.23%,问氯元素的相对原子质量为多少?
解:34.969×75.77%+36.966×24.23%=35.453
原子的近似相对原子质量:等于质量数。
元素的近似相对原子质量:用各核素的质量数和对应的个数百分比求得。
(4)氢的三种核素
2、原子结构中质子、中子、电子的化学意义
质子数决定原子属于哪种元素。
中子数和质子数一起决定元素的哪种核素。
核外电子和质子数一起决定原子的化学性质。
3、同位素的用途
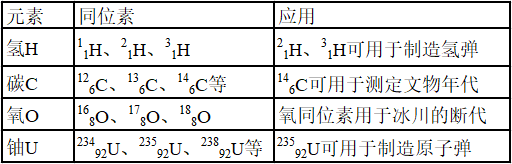
4、放射性同位素:
(1)同位素中,有些有放射性,这样的同位素叫放射性同位素。
(2)半衰期:放射性元素的原子核有半数发生衰变时所需要的时间。
原子核的衰变规律是:N=N0×(1/2)t/T
N0是指初始时刻(T=0)时的原子核数,t为衰变时间,T为半衰期,N是衰变后留下的原子核数。
放射性元素的半衰期长短差别很大,短的远小于一秒,长的可达数百亿年。
5、纯净物不区分核素。
由H2、HD、D2、HT、DT、T2组成的气体还是氢气,还是纯净物,还是单质。
由H2O、HDO、D2O、HTO、DTO、T2O组成的液体还是水,还是纯净物,还是化合物。
四、原子结构与元素的性质
研究的是原子结构与元素性质之间的关系。
1、金属元素的原子的最外层电子一般少于4个,在化学反应中容易失去电子,具有金属性(还原性)。
非金属元素的原子的最外层电子一般多于4个,在化学反应中容易得到电子,具有非金属性(氧化性)。
2、碱金属元素
(1)在自然界中都以化合态存在。
(2)碱金属元素包括:Ia族,除H之外。
有Li(锂)、Na(钠)、K(钾)、Rb(铷)、Cs(铯)、Fr(钫)
(3)画出各原子结构示意图,并观察和【推理】
碱金属元素在原子结构上相似的地方:最外层电子数都有1个,都容易失去电子,化学性质中显示为强还原性和强金属性。
在原子结构上递变的地方:从上到下,核电荷数增加,电子层数递增,原子半径逐渐变大,失电子能力逐渐?,金属性(还原性)逐渐?
(告诉学生:核电荷数的增加,使原子核对电子的作用力变大,会导致电子不易失去。而原子半径的增加,使原子核对电子的作用力减小,会导致电子容易失去。这对上面的失电子能力推理是一对矛盾,需要用实验来证明。下面的实验是证明实验。)
(4)【实验】K的燃烧,K与水的反应。
实验现象:K在空气中能燃烧且比Na更快速,K与水能反应且比Na更剧烈。
【结论】
①碱金属元素的化学性质相似,都与氧气、水反应,反应后都是+1价。
4L i+O2 2L i2O(直接给出产物)
2L i2O(直接给出产物)
2Na+O2 Na2O2
Na2O2
2Na+2H2O=2NaOH+H2↑
2K+2H2O=2KOH+H2↑
②碱金属元素的化学性质具有递变性,从上到下,失电子能力变强,还原性和金属性都变强。
(4)碱金属单质物理性质的相似性和规律性
①都是银白色金属,都很软,都有延展性,导热性和导电性都很好,密度都比较小,熔点都比较低。
②递变性:【看表总结】从上到下密度逐渐变大。从上到下熔沸点逐渐降低。
(5)金属性强弱的判断方法
①与水或酸反应生成氢气的难易程度:反应越容易,元素的金属性越强。
与水反应:Li与水反应慢,Na与水反应较快,K与水反应更快,铷和铯遇水甚至会爆炸。
②最高价氧化物的水化物(最高价氢氧化物)的碱性:氢氧化物的碱性越强,元素的金属性越强。
氢氧化物的碱性:LiOH<NaOH<KOH<rBOH<CsOH。
LiOH是强碱,溶于水。
3、卤族元素
(1)在自然界中都以化合态存在。
(2)卤族元素包括VIA族。有F(氟)、Cl(氯)、Br(溴)、I(碘)、At(砹)、Ts(“石田”)
(3)画出各原子结构示意图,并观察和【推理】
卤族元素在原子结构上相似的地方:最外层电子数都有7个,都容易得到电子,化学性质中显示为强氧化性和强非金属性。
在原子结构上递变的地方:从上到下,核电荷数增加,电子层数递增,原子半径逐渐变大,得电子能力逐渐减弱,氧化性逐渐减弱,非金属性逐渐减弱。
下面用资料和实验来验证。
(4)【预测】与Cl2相比,F2与氢气的反应能力变强,Br2、I2与氢气的反应能力变弱。
HF比HCl稳定性更强,HBr、HI的稳定性更差。
【表格对比】卤素单质与氢气的反应条件及氢化物的稳定性

【结论】
①F2、Cl2、Br2、I2与H2反应的条件越来越高。
HF、HCl、HBr、HI的稳定性越来越差。
②卤族元素的化学性质相似,都与氢气反应,反应后都是-1价。
(5)【实验】卤素单质间的置换反应
①在KBr溶液、KI溶液中分别加入氯水

现象:KBr溶液变为橙黄色,加入少量CCl4充分振荡后,CCl4变为橙红色。
化学方程式为:2KBr+Cl2=2KCl+Br2

KI溶液变为棕黄色,加入少量CCl4充分振荡后,CCl4变为紫色。
化学方程式为:2KI+Cl2=2KCl+I2
②在KI溶液中加入溴水
KI溶液变为棕黄色,加入淀粉溶液,溶液变为蓝色。
化学方程式为:2KI+Br2=2KBr+I2
【结论】以上实验可以验证,卤素单质的氧化性:Cl2>Br2>I2。
(6)非金属性强弱的判断方法
①与氢气反应的难易程度:与氢气反应越容易,元素的非金属性越强。
②最低价氢化物的稳定性:氢化物越稳定,元素的非金属性越强。
③最高价氧化物的水化物(最高价含氧酸)的酸性:最高价含氧酸的酸性越强,非金属性越强。
最高价含氧酸的酸性:HClO4>HBrO4>HIO4。(三者都是强酸)
(7)卤化氢的酸性:氢化物的水溶液的酸性依次增强,HF<HCl<HBr<HI。HF是弱酸,其它都是强酸。原因是卤化氢的稳定性越低,卤化氢越容易电离为离子。
(8)卤素单质物理性质及规律性
①F2是淡黄绿色气体,Cl2是黄绿色气体,Br2是深红棕色液体,I2是紫黑色固体。
Br2易挥发,I2易升华。

②规律性:从上到下密度逐渐变大。从上到下熔沸点逐渐升高。
(9)溶液中Cl-、Br-、I-的检验方法:

先滴加少量稀HNO3,再滴加几滴AgNO3。
若有白色沉淀生成,则有Cl-。
若有淡黄色沉淀生成,则有Br-。
若有黄色沉淀生成,则有I-。

- 全部评论(0)
