关于Cl-的配位能力
时间:2023-09-25 15:20 来源:未知 作者:化学自习室 点击: 次 所属专题: 氯离子 配体
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
Cl-的外层具有四对孤电子对,所以可做为配体,与盐类化合物形成配位化合物。
例如CuCl2,以固体形式存在或在浓盐酸或NaCl浓溶液中,呈现深黄色,原因是其中有[CuCl4]2-的存在。将CuCl2固体溶解于大量水中,或将其浓溶液加水稀释,则溶液逐渐由黄色到绿色直到蓝色,深黄色配离子[CuCl4]2-逐渐转变成蓝色水合离子[Cu(H2O)4]2-:
[CuCl4]2-+4H2O=[Cu(H2O)4]2++4Cl-
深黄色 蓝色
以上两种离子混合时为绿色。
金属铅与稀盐酸反应生成白色的PbCl2沉淀,遇到浓盐酸时,将生成无色的[PbCl4]2-配离子而沉淀消失。
向Hg(NO3)2溶液中滴加KI溶液,首先可以观察到红色HgI2沉淀的形成:
Hg2++2I-=HgI2↓
当加入的KI溶液过量时,可看到之前的红色HgI2沉淀逐渐消失,形成[HgI4]2-配离子,得到无色溶液:
HgI2+2I-=[HgI4]2-
以上各反应充分说明,-1价的卤素离子可作为路易斯碱提供电子对,向中心离子配位,形成配位化合物。但由于﹣1价的卤素离子作为路易斯碱其软硬程度很不一致,所以形成的配位化合物稳定与否可以依据“软亲软、硬亲硬”的原则进行初步的判断。
高考题中也有这样的隐含知识,虽然我们不用给学生讲授,但作为教师要究其原因,扩充自己的知识容量。
(2020·山东卷,9)以菱镁矿(主要成分为MgCO3,含少量SiO2,Fe2O3和Al2O3)为原料制备高纯镁砂的工艺流程如下:
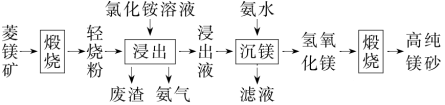
已知浸出时产生的废渣中有SiO2,Fe(OH)3和Al(OH)3。
下列说法错误的是( )
A.浸出镁的反应为MgO+2NH4Cl===MgCl2+2NH3↑+H2O
B.浸出和沉镁的操作均应在较高温度下进行
C.流程中可循环使用的物质有NH3、NH4Cl
D.分离Mg2+与Al3+、Fe3+是利用了它们氢氧化物Ksp的不同
这里NH4Cl电离产生的Cl-能与Fe2O3和Al2O3形成[FeCl4]-、[AlCl4]-进而在弱酸性环境下完全沉淀为Fe(OH)3和Al(OH)3沉淀。此酸性环境Mg2+未开始沉淀。本题答案选B。
(2019-I)一种以硼镁矿(含Mg2B2O5·H2O、SiO2及少量Fe2O3、Al2O3)为原料生产硼酸及轻质氧化镁的工艺流程如下:
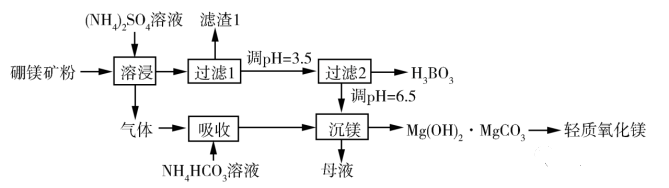
这里“滤渣1”的主要成分有_________。
答案:SiO2、Fe2O3、Al2O3
这是由于(NH4)2SO4无法与Fe2O3和Al2O3形成配合物,从而不溶解。
作为教师在讲授这两道题时,应该引导学生用好题干给予的有效知识,如2019-I卷这道题,只需根据流程后续未除铁铝说明在过滤I已除去,又根据对滤液进行pH调控才降为3.5,说明此前pH较大,不能溶解Fe2O3和Al2O3。故沉淀的主要成分是SiO2、Fe2O3、Al2O3。

- 全部评论(0)
