元素拓展:锡及其化合物总结
时间:2023-10-07 14:34 来源:未知 作者:化学自习室 点击: 次 所属专题: 锡及其化合物
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、锡单质
(1)锡有三种同素异形体,他们之间的转化关系为灰锡(α锡),白锡(β锡)、脆锡。
锡制品是白锡的制成,但是长期处于低温会毀坏,这是β锡转变为α锡的缘故,这一现象叫做锡瘟,灰锡是粉末状,β锡在低于13.6℃转变为α锡,α锡本身就是这类反应的催化剂。
(2)锡是两性金属,与稀盐酸缓慢作用,与浓盐酸在加热条件下反应加快:
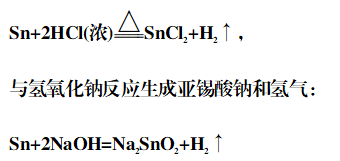

二、氧化物
二氧化锡是锡最重要的化合物,是锡石的主要成分。它不溶于水,也难溶于酸或碱的水溶液,但与NaOH或Na2CO3和S共熔,可转变为可溶性的盐:

SnO2+2NaOH=Na2SnO3(锡酸钠)+ H2O,
SnO2+2Na2CO3+4S=Na2SnS3(硫代锡酸钠)+ Na2SO4+2CO2↑
三、氢氧化物
氢氧化锡是两性氢氧化物,既可溶于酸又可溶于
Sn(OH)2+2HCl=SnCl2+2H2O,
Sn(OH)2+2NaOH=Na2SnO2+2H2O.
四、锡盐
Sn2+与Sn4+均易水解:
SnCl2+H2O=Sn(OH)Cl(白色)+HCl;
SnCl4+4H2O=Sn(OH)4↓+4HCl;
故配制SnCl2溶液要使用盐酸,抑制Sn2+水解;
Sn2+在空气中被氧气氧化:
2Sn2++O2+4H+=2Sn4++2H2O,
要加入单质Sn,防止Sn2+被氧化,这一点与Fe2+相似。
(责任编辑:化学自习室)

说点什么吧
- 全部评论(0)
还没有评论,快来抢沙发吧!
