元素推断的“题眼”有多少
时间:2024-01-17 11:14 来源:未知 作者:化学自习室 点击: 次 所属专题: 元素推断
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
元素推断题是高考考查的热点,这类题往往将元素化合物的知识、物质结构理论、化学基本理论等知识串联起来,综合性较强,难度较大。解题的关键是正确推断元素,推断元素的突破口在于抓住“题眼”,即元素的特性。
一、元素之最
1.地壳中质量分数最大的元素是O,其次是Si
2.地壳中质量分数最大的金属元素是Al
3.氢化物中氢元素百分含量最高的元素是C
4.其单质为天然物质中硬度最大的元素是C
5.其气态氢化物最易溶于水的元素是N
6.其氢化物沸点最高的非金属元素是O
7.所形成化合物种类最多的元素是C
8.其单质最易液化的气体的元素是Cl
9.其单质最轻的金属元素是L I
10.其最高价氧化物的水化物酸性最强的元素是Cl
11.单质与水反应最剧烈的非金属元素是F
12.在空气中,其一种同素异形体最易自然的元素是P
13.其单质最轻的元素是H
14.短周期中离子半径最大的元素是P
15.短周期中最活泼的金属元素是Na、非金属元素是F
16.短周期中原子半径最大的元素是N A(除稀有气体),最小的是H
17.最活泼的非金属单质:F2
18.最活泼的金属:Cs
19.常温下能跟H2O 反应放出O2的单质是F2,化合物是Na2O2
20.熔沸点最低的是He
二、物质的特性
1.常温下,其单质是有色气体的元素是F 、Cl
2.在空气中其最高价氧化物的含量增加会导致温室效应的元素是C
3.常温下其单质呈液态的非金属元素是Br
4.其气态氢化物与最高价氧化物对应水化物能起化合反应的是N
5.其气态氢化物与其低价氧化物能反应生成该元素的单质的元素是S 、N
6.其气态氢化物的水溶液可雕刻玻璃的是F
7.其两种同素异形体对人类生存都非常重要的元素是O
8.能导电的非金属单质是石墨和晶体硅
9.能溶于强碱溶液反应放出H2的金属元素是a L 、非金属元素是Si
10.气态单质在另一种气体单质中燃烧发出苍白色火焰的是H2、另一种气体为Cl2
11.金属单质在气体氧化物中燃烧生成黑白两种固体混合物的是Mg ,气体为CO2
12.单质固体在另一气体单质中燃烧产生白色烟雾的是P ,另一种气体是Cl2
13.常见短周期元素和氧元素能形成X2y 或X2Y2型化合物的是Na、H
14.其最高价氧化物对应水化物是白色胶状沉淀的是Si、Al
15.其最高价氧化物对应水化物是蓝色沉淀的是Cu ,红褐色沉淀的是Fe
16.其单质常温下在浓硫酸或浓硝酸中钝化的是Al 、Fe
17.其氧化物会导致酸雨的元素是S 、N
18.其氧化物能使品红褪色,加热又恢复原色的是S
19.常温下其气体单质能使湿润的淀粉K I 试纸变蓝的元素是Cl、O, 即Cl2、O3
20.其气态氢化物能使湿润的红色石蕊试纸变蓝的元素是N
21.其单质、氧化物及氧化物对应的水化物与酸、碱都能反应的是Al
三、前18号元素原子结构的特殊性
1.原子核中无中子的原子为H
2.最外层有1个电子的原子为H 、Li 、Na
3.最外层有2个电子的原子为He 、Be 、Mg
4.最外层电子数等于次外层电子数的原子为Be 、Ar
5.最外层电子数是次外层电子数2倍的原子为C
6.最外层电子数是次外层电子数3倍的原子为O
7.最外层电子数是次外层电子数4倍的原子为Ne
8.电子层数与最外层电子数相等的原子为H 、Be 、Al
9.电子总数为最外层电子数2倍的原子为Be
10.次外层电子数是最外层电子数2倍的原子为Li 、Si
四、两组特殊微粒
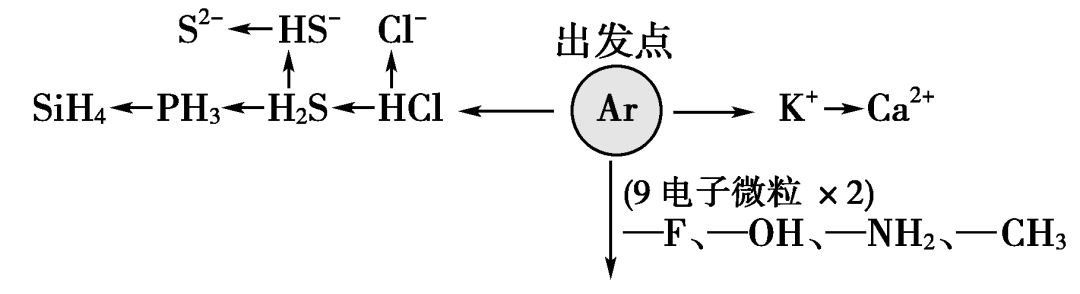
1.“10电子”微粒
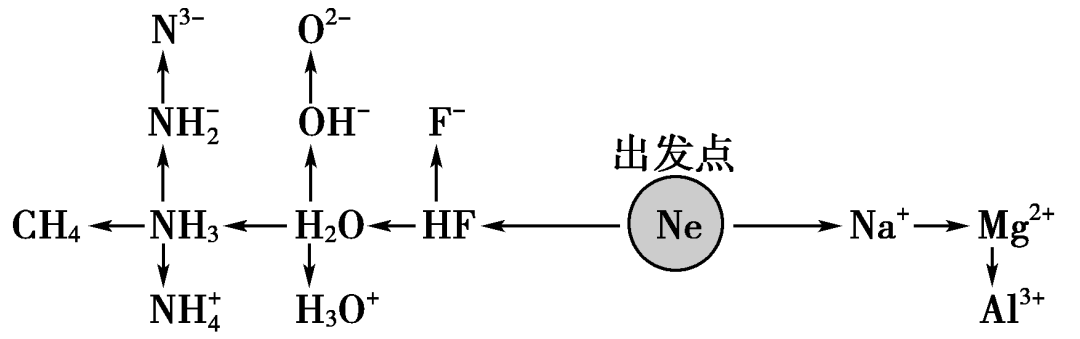
2.“18电子”微粒
典例剖析
典例1.短周期主族元素W、X、Y、z的原子序数依次增大,四种元素组成的一种分子簇的球棍模型如图所示。W与X不在同一周期,x原子的最外层电子数与核外电子总数之比为3∶4,z的周期数等于族序数。下列说法不正确的是( )
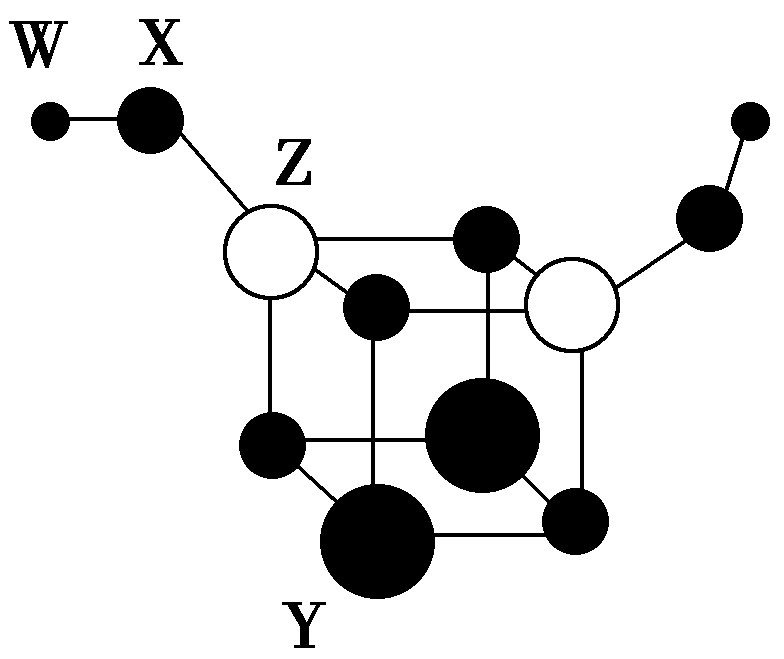
A.化学式为Y2Z2X6W2
B.X分别与Y、z形成的化合物为离子化合物
C.简单离子的半径:X> Y> Z
D.Y、Z的简单离子均可抑制水的电离
解析:短周期主族元素W、X、Y、z的原子序数依次增大,X原子的最外层电子数与核外电子总数之比为3∶4,由于最外层电子数不超过8,原子只能有2个电子层,最外层电子数为6,故x为O元素;z的周期数等于族序数,其原子序数大于氧,只能处于第三周期,故z为Al;W、X(氧)位于不同周期,且W的原子半径小于氧的半径,可推知W为H元素;根据图示可知,四种元素组成的分子簇化学式为H2Al2O6Y2,结合化合物中各元素化合价代数和为0可知,Y的化合价为+2,其原子半径大于Al,则Y为Mg元素。A.由图可知,该分子的化学式为Y2Z2X6W2,故A正确;B. O分别与Mg、Al形成的化合物为MgO、Al2O3,均为离子化合物,故B正确;C.O2-、Mg2+、Al3+的核外电子排布相同,核电荷数越大,离子半径越小,则简单离子的半径:O2->Mg2+>Al3+,故C正确;D. Mg2+、Al3+均为可水解的弱离子,均可促进水的电离,故D错误。
答案:D
典例2.短周期主族元素X、Y、Z、W的原子序数依次增大,其中Y、Z位于同一主族。x的气态氢化物常用作制冷剂。ZYW2与水剧烈反应,可观察到液面上有白雾生成,并有刺激性气味的气体逸出,该气体可使品红溶液褪色。下列说法正确的是( )
A.最简单氢化物的沸点:Z>Y
B.原子半径:W>Z>Y>X
C.把ZY2通入石蕊试液中,石蕊先变红后褪色
D.向ZYW2与水反应后的溶液中滴加AgNO3溶液有白色沉淀生成
解析:短周期主族元素X、Y、Z、W的原子序数依次增大,其中Y、Z位于同一主族。x的气态氢化物常用作制冷剂,则x为n(元素);ZYW2能与水剧烈反应,可观察到液面上有白雾生成,并有刺激性气味的气体逸出,该气体可使品红溶液褪色,该气体为SO2,结合Y、Z位于同一主族可知,Y为O,Z为S元素;W的原子序数大于S,且为短周期主族元素,则W为Cl元素。A. Y和Z简单氢化物分别为H2O和H2S,常温常压下,H2O为液态,H2S为气态,则沸点大小:Y>Z,Z>W,故A错误; B.同周期元素原子半径随核电荷数增大而减小,同主族元素原子半径随核电荷增大而增大,则X>Y,故B错误;C. ZY2为SO2,通入石蕊试液中,石蕊变红但不褪色,故C错误;D. ZYW2与水反应后的溶液中存在Cl-,则滴加AgNO3溶液有白色氯化银沉淀生成,故D正确。
答案:D
典例3.短周期元素X、 Y、Z、M原子序数依次增大,Z的基态原子2P轨道半充满,M的最高正价与最低负价绝对值之差为4,它们组成的一种分子结构如图。下列说法正确的是( )
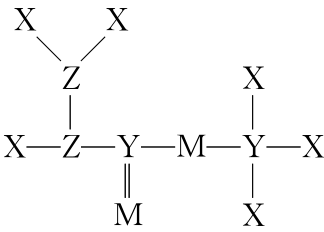
A.电负性:X>Y>Z
B.原子半径:Y>Z>X
C.分子中Z原子的杂化方式均为sp2
D.Y、Z、M的最高价氧化物的水化物均为强酸
解析:已知X、Y、Z、M为原子序数依次增大的短周期元素,Z的基态原子2P轨道半充满,则Z为N元素,M的最高正价与最低负价绝对值之差为4,则M为S元素,4种元素组成的一种分子结构如题图,根据共价键数目可推知,则X为H元素,Y为C元素。A.由上述分析可知,X为H元素,Y为C元素,z为N元素,则电负性:N>C>H,A错误;B.H原子核外有1个电子层,而C、N原子核外均有2个电子层,电子层数越多,半径越大,电子层数相同,核电荷数越大,半径越小,则原子半径:C>N>H,B正确;C.分子中N原子均形成共价单键,为sp3杂化,C错误;D.C元素的最高价氧化物的水化物为H2CO3,H2CO3为弱酸,D错误。
答案:B
走进高考
1.(2022·湖南卷)科学家合成了一种新的共价化合物(结构如图所示),X、Y、Z、W为原子序数依次增大的短周期元素,W的原子序数等于X与Y的原子序数之和。下列说法错误的是( )
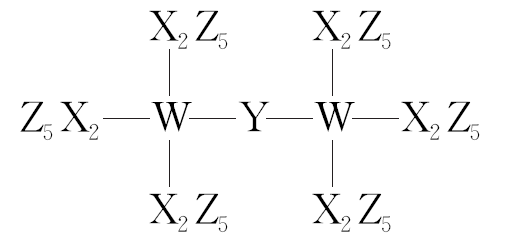
A.原子半径:X>Y>Z
B.非金属性:Y>X>W
C.z的单质具有较强的还原性
D.原子序数为82的元素与W位于同一主族
答案: C
解析:由共价化合物的结构可知,X、W形成4个共价键,y形成2个共价键,z形成1个共价键,X、Y、Z、W是原子序数依次增大的短周期元素,W的原子序数等于x与y的原子序数之和,则X为C元素、Y为O元素、Z为F元素、W为Si元素。同周期元素从左到右原子半径依次减小,则C、O、F的原子半径:C>O>F,故A正确;同周期元素从左到右元素的非金属性依次增强,同主族元素从上到下元素的非金属性依次减弱,则C、O、Si的非金属性:O>C>Si,故b正确;氟元素的非金属性最强,单质具有很强的氧化性,故C错误;原子序数为82的元素为铅元素,原子结构示意图为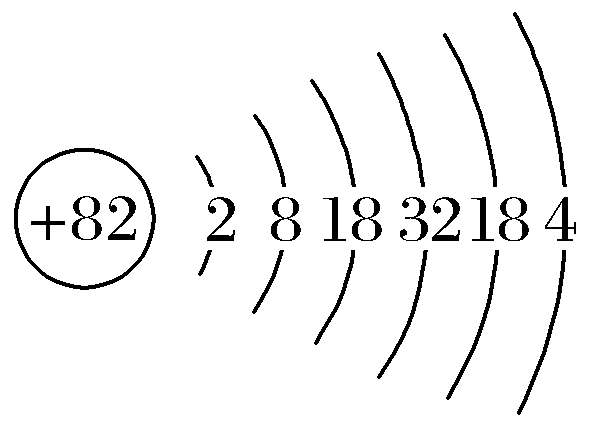 ,与硅元素都位于元素周期表第ⅣA族,故D正确。
,与硅元素都位于元素周期表第ⅣA族,故D正确。
2.(2021·广东高考,13)一种麻醉剂的分子结构式如图所示。其中,X的原子核只有1个质子;元素Y、Z、W原子序数依次增大,且均位于X的下一周期;元素E的原子比W原子多8个电子。下列说法不正确的是( )
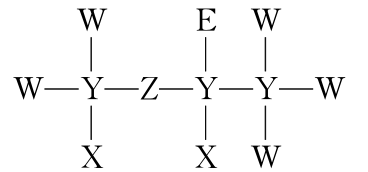
A.XeZ4是一种强酸
B.非金属性:W>Z>Y
C.原子半径:Y>W>E
D.ZW2中,Z的化合价为+2价
答案:C
解析:题给化合物结构中X、W、E均形成1个共价键、Y形成4个共价键、Z形成2个共价键。x的原子核只有1个质子,则X为H元素;元素Y、Z、W原子序数依次增大,且均位于X的下一周期,即第二周期元素,则Y为C元素,Z为O元素,W为F元素;元素E的原子比W原子多8个电子,则E为Cl元素,综合以上分析可知,X、Y、Z、W、E分别为H、C、O、F、Cl元素。A.氯元素非金属性较强,其最高价氧化物的水化物HClO4是一种强酸,故A正确;B.同一周期元素从左到右非金属性逐渐增强,所以非金属性:F>O>C,故B正确;C.同一周期从左到右原子半径逐渐减小,同一主族从上到下原子半径逐渐增大,电子层越多半径越大,所以原子半径:Cl>C>F,故C错误; D.OF2中,F为-1价,则O的化合价为+2价,故D正确。

- 全部评论(0)
