系统总结孤电子对数的计算
时间:2024-03-20 08:11 来源:未知 作者:化学自习室 点击: 次 所属专题: 孤电子对数计算 价层电子对数计算
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
对于ABn型分子,
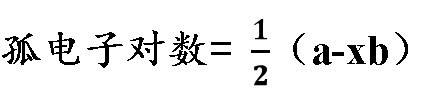
其中:①a表示中心原子的价电子数;
对主族元素:a=最外层电子数;
对于阳离子:a=价电子数-离子所带电荷数;
对于阴离子:a=价电子数+离子所带电荷数。
②x表示与中心原子结合的原子数。
③b表示与中心原子结合的原子最多能接受的电子数,氢为1,
其他原子=8-该原子的价电子数,如Cl为1,S为2等。
注:价层电子对互斥模型对分子空间结构的预测少有失误,但它不能用于预测以过渡金属为中心原子的分子。(以上来源于高中化学课本)
通过分析式子(1/2)*(a-xb),我们可以得到:xb 是与中心原子结合的原子最多能接受的电子数之和。
基于以上结论,我们可以来分析多种原子构成的分子结构。
例如:HCHO
中心原子为:C
a = 4
与碳原子结合的原子为:2个氢原子(H)以及一个氧原子(O),因此最多能接受的电子数之和为:2个氢原子结合2个电子,一个氧原子结合2个电子,共4个电子。
因此 孤电子对数= (1/2)*[4-(2*1+2)]=0
例如:HCN
中心原子为:C
a = 4
与碳原子结合的原子为:1个氢原子(H)以及一个氮原子(N),因此最多能接受的电子数之和为:1个氢原子结合1个电子,一个氮原子结合3个电子,共4个电子。
因此 孤电子对数= (1/2)* [4-(1+3)]=0
除了以上提到的类型,在有机中用杂化轨道理论解释中心原子杂化轨道类型(sp,sp2)时,也面临着对中心原子的孤电子对数的计算。并且这一类的计算,经常有同学提问。
以乙烯为例:
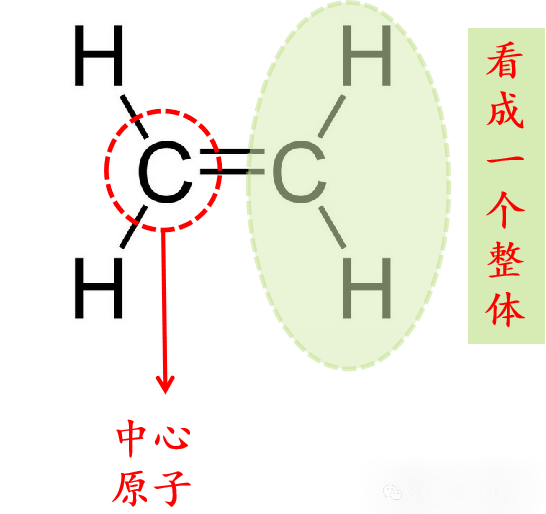
中心原子为:C
a = 4
与碳原子结合的原子为:2个氢原子(H)以及一个CH2。(一个C原子结合4个电子达到8电子稳定结构,CH2中已经结合了2个氢原子(2个电子)了,因此一个CH2最多还可以结合2个电子)
因此最多能接受的电子数之和为:2个氢原子结合2个电子,一个CH2结合2个电子,共4个电子。
因此 孤电子对数= (1/2)* [4-(2*1+2)]=0
乙炔是同样的:
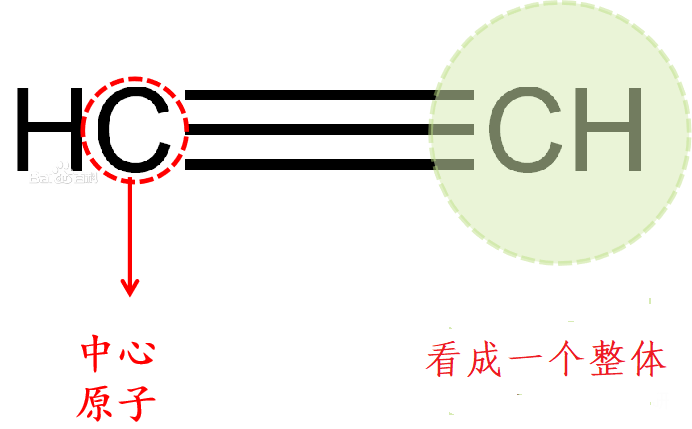
中心原子为:C
a = 4
与碳原子结合的原子为:1个氢原子(H)以及一个CH。(一个C原子结合4个电子达到8电子稳定结构,CH中结合了1个氢原子(1个电子),因此一个CH还可以结合3个电子)
因此最多能接受的电子数之和为:1个氢原子结合1个电子,一个CH结合3个电子,共4个电子。
因此 孤电子对数= (1/2)*[4-(1+3)]=0

- 全部评论(0)
