配合物中心离子杂化类型、稳定性与配位数的判断
时间:2024-04-07 17:05 来源:未知 作者:化学自习室 点击: 次 所属专题: 配合物稳定性 杂化轨道类型 配合物配位数
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
配位化合物的空间构型:
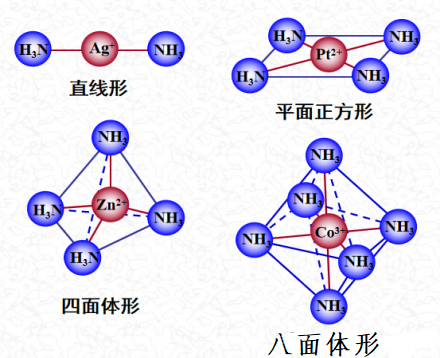
二配位:直线型;四配位:正四面体型或平面正方形;六配位(无孤电子对):三角双锥;八配位(无孤电子对):八面体构型。
形成配位键的必要条件:
中心原子有空轨道,配位体有孤对电子
[Ag(NH3)2]+:Ag 4d105s1 Ag+ 4d10 sp杂化外轨型 直线型;
配位数为4的配合物的杂化方式及空间构型
[NiCl4]2-: Ni 3d84s2 Ni2+ 3d8 sp3杂化 正四面体;
[Ni(CN)4]2-:Ni 3d84s2 Ni2+ 3d8 dsp2杂化 平面正方形;
配位数为6的配合物的杂化方式及空间构型
[FeF6]3-:Fe 3d64s2 Fe3+ 3d5 sp3d2杂化 八面体;
[Fe(CN)6]3-: Fe 3d64s2 Fe3+ 3d5 d2sp3杂化 八面体。
配合物的稳定性
外轨型配合物和内轨型配合物的定义:
①中心原子采用外层的ns、np、nd轨道杂化所形成的配合物称外轨型配合物。如:[NiCl4]2-、[FeF6]3-。
②中心原子采用内层的(n-1)d、ns、np轨道杂化所形成的配合物称内轨型配合物。如:[Ni(CN)4]2-、[Fe(CN)6]3-。
形成条件:
电负性高的配位原子,易生成外轨型配合物,如:卤素、H2O;电负性低的配位原子,易生成内轨型配合物,如:CN-、NO2-;NH3介乎于两种情况之间:时内时外,中心离子的电荷增多,有利于形成内轨型配合物[Co(NH3)6]3+。
形成原因:

稳定性
由于(n-1)d轨道的能量比nd轨道的能量低对同一个中心体而言,一般内轨型配合物比外轨型配合物稳定。
配合物的配位数是指直接同中心离子(或原子)配位的原子数目。高中化学配合物的配位数可按如下方法判断:
1.配合物的配位数等于配位原子及配位体的数目
有两种情况:
(1)配位原子数目、配位体数目、中心离子与配位原子形成的配位键键数均相等
例如[Ag(NH3)2]nO3、[Cu(NH3)4]SO4、[Cu(H2O)4]2+、[Zn(NH3)4]2+、K3[Fe(SCN)6]、[FeF6]3-、Ni(CO)4、Fe(CO)5、[Co(NH3)4(H2O)2]Cl2、[CrCl(H2O)5]Cl2等配合物或配离子,它们配位体的数目以及中心离子与配位原子形成的配位键键数相等。其中Ag+离子的配位数为2,Cu2+离子与Zn2+离子的配位数均为4,Fe3+离子的配位数为6。Ni(CO)4、Fe(CO)5等羰基化合物中Ni、Fe 原子的配位数分别为4、5,[Co(NH3)4(H2O)2]Cl2、[CrCl(H2O)5]Cl2中Co2+离子与Cr3+离子的配位数均为6。
(2)配位原子、配位体的数目均不等于中心离子与配位原子形成的配位键键数
例如[BF4]-、[B(OH)4]-、[AlCl4]-、[Al(OH)4]-等配离子中,B、Al原子均缺电子,它们形成的化学键,既有共价键,又有配位键,配位数与配位键的键数不相等,配位数均为4。
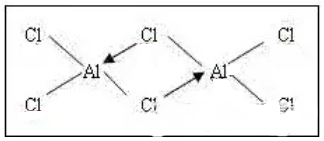
又如Al2Cl6(下图)中Al原子的配位数为4。
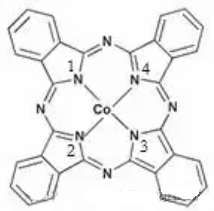
再如酞菁钴的结构(下图),钴离子的配位数为4。
2.配位数等于配位原子的数目,但不等于配位体的数目
存在多基配体时有这种情况,例如[Cu(en)2]中的en是乙二胺(NH2CH2CH2NH2)的简写,属于双基配体,每个乙二胺分子有2个N 原子与Cu2+离子配位,故Cu2+离子的配位数是4而不是2。
3.配合物的配位数可以按中心离子电荷数的两倍来计算
如果不知道配合物的化学式,一般可按此规律计算。例如前面提到的,Ag+离子的配位数为2,Cu2+离子与Zn2+离子的配位数均为4,Fe3+离子的配位数为6,等等。
不过应注意,某些配合物不符合以上规律,如[Co(NH3)4(H2O)2]Cl2、[CrCl(H2O)5]Cl2中Co2+离子与Cr3+离子的电荷数分别为2、3,但配位数都是6。
若配合物中的中心原子呈电中性,如金属的羰基化合物,其配位数只能在已知化学式的基础上判断。
有些配合物,当中心离子(或原子)与不同量的配位体配合时,其配位数并不确定。配位数多少与中心离子和配体的性质(如电荷数、体积大小、电子层结构等)以及它们之间相互影响、配合物的形成条件(如浓度、温度等)有关。配位数由1到14均可能,其中最常见的配位数为4和6。例如硫氰合铁络离子随着配离子SCN-浓度的增大,中心离子Fe3+与SCN- 可以形成配位数为1~6的配合物:[Fe(SCN)n]3-n (n=1~6)。

- 全部评论(0)
