晨读笔记:氯及其化合物
时间:2023-08-09 15:54 来源:未知 作者:化学自习室 点击:次 所属专题: 氯及其化合物
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
01.氯原子容易得到1个电子而形成Cl-,表现出典型的氧化性。
02.氯在自然界中以化合态存在,以NaCl、MgCl2、CaCl2等形式存在于海水、盐湖和盐矿中。
03.氯气黄绿色、有刺激性气味的有毒气体,易液化。
04.Cl2可溶于水(1:2),难溶于饱和食盐水,故Cl2中含有的HCl可以用饱和食盐水除去。
05.液态的氯称为液氯,其水溶液称为氯水,液氯是纯净物,氯水是混合物。
06.闻气体味道时,用手轻轻地在瓶口闪动,使极少量的气体飘进鼻孔。
07.氯气与钠反应:2Na+Cl2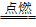 2NaCl (反应现象:产生大量白烟,火焰为黄色)
2NaCl (反应现象:产生大量白烟,火焰为黄色)
08.氯气与铁反应:2Fe+3Cl2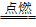 2FeCl3 (反应现象:产生大量棕黄色烟)
2FeCl3 (反应现象:产生大量棕黄色烟)
09.氯气与铜反应:Cu+Cl2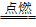 CuCl2(反应现象:产生大量棕黄色烟)
CuCl2(反应现象:产生大量棕黄色烟)
10.反应中Cl2表现强氧化性,变价金属被氧化为高价态,如Cu、Fe被Cl2氧化为Cu2+、Fe3+。
11.Fe和Cl2反应,无论Fe过量或不足,只能生成FeCl3
12.在常温下,液氯与铁不反应,液氯一般保存在钢瓶中,但必须为干燥氯气。
13.与氢气反应,H2+Cl2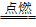 2HCl,H2在Cl2中能安静地燃烧,发出苍白色火焰,瓶口有白雾
2HCl,H2在Cl2中能安静地燃烧,发出苍白色火焰,瓶口有白雾
此反应用于工业制盐酸。
14.H2+Cl2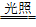 2HCl,剧烈反应,会发生爆炸,瓶口有白雾,不能用于工业制盐酸,原因是H2和Cl2混合后光照,反应瞬间完成,放出的热量使气体急剧膨胀而发生爆炸
2HCl,剧烈反应,会发生爆炸,瓶口有白雾,不能用于工业制盐酸,原因是H2和Cl2混合后光照,反应瞬间完成,放出的热量使气体急剧膨胀而发生爆炸
15.2P+3Cl2 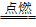 2PCl3 (Cl2不足)
(三氯化磷是液体,呈雾状)
2PCl3 (Cl2不足)
(三氯化磷是液体,呈雾状)
16.2P+5Cl2 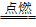 2PCl5 (Cl2充足) (五氯化磷是固体,呈白烟状)
2PCl5 (Cl2充足) (五氯化磷是固体,呈白烟状)
17.磷在氯气中剧烈燃烧,在集气瓶口产生白色烟雾,磷在Cl2中燃烧中学化学中唯一的烟、雾同时生成的一个反应,高中阶段,烟为雾有着严格的区分,固态为烟,液态为雾。
18.与硅的反应:Si+2Cl2 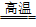 SiCl4
SiCl4
19.燃烧不一定有氧气参加,燃烧的本质是氧化还原反应,剧烈的发光发热的反应都可称为燃烧。
20.氯气溶于水后形成氯水,部分氯气会与水反应,Cl2+H2O===HCl+HClO,该反应中的氧化剂为Cl2,还原剂也是为Cl2,为歧化反应。
21.证明Cl2 + H2O⇌HCl + HClO存在可逆过程的依据是氯水呈浅黄绿色,由于HCl、HClO均为无色,若是一个单向反应,则氯水应无色,而氯水呈浅黄绿色则证明氯水还有氯气分子存在。
22.氯水的成份是“三分子,四离子”,分别是:H2O、HClO、Cl2及H+、Cl-、ClO-、OH-。
23.由于氯水是混合体系,它具有各组分的性质,氯水具有以下典型性质:
a.强氧化性是由Cl2、HClO体现的;
2FeCl2+Cl2===2FeCl3
SO2+Cl2+2H2O===2HCl+H2SO4
Na2SO3+Cl2+H2O===2HCl+Na2SO4
b.强酸性是由HCl体现的;Cl2+NaHCO3===NaCl+CO2+HClO
c.漂白性是由HClO体现的;
如:向氯水中滴加紫色石蕊溶液,先变红(H+作用的结果),后褪色(HClO作用的结果)
d.溶液中的Cl-还能与Ag+反应生成沉淀。
24.氯气可用于自来水消毒,故自来水中会含有一定浓度的Cl-,不能用来配制AgNO3溶液。
25.次氯酸HClO的结构式是H-O-Cl,要注意氧和氯的相对位置。
26.次氯酸HClO的化性有 以下性质:
①弱酸性:HClO H++ClO-,但HClO酸性比碳酸酸性弱,但比HCO3-强。
H++ClO-,但HClO酸性比碳酸酸性弱,但比HCO3-强。
向NaClO溶液中通入CO2, CO2少量和过量反应均为:NaClO+H2O+CO2=NaHCO3+HClO。
原因是酸性:H2CO3>HClO>HCO3-,即HClO+CO32-= HCO3-+ ClO-
②不稳定性:2HClO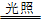 2HCl + O2↑,光照氯水时,溶液中的次氯酸不断分解生成盐酸和氧气,溶液的浅黄绿色逐渐褪去,pH逐渐减小
2HCl + O2↑,光照氯水时,溶液中的次氯酸不断分解生成盐酸和氧气,溶液的浅黄绿色逐渐褪去,pH逐渐减小
③强氧化性(漂白性) :
27.氯水、次氯酸应保存在棕色试剂瓶中,低温避光保存,是为了减少HClO见光分解。
28.久置的氯水就是稀盐酸,故氯水需要现在配现用。
29.HClO和ClO-都具有强氧化性,ClO-无论是在酸性、碱性、中性都有强氧化性。
30.次氯酸将有色物质氧化成稳定的无色物质,此过程不可逆转。
31.很多有色有机物遇次氯酸都会褪色,这一过程称为漂白。
32.有色无机物反应后褪色,一般不称为漂白。
33.活性炭也能吸附有色物质,称为吸附漂白,此过程也不可逆转。
34.常温时Cl2+2NaOH===NaCl+NaClO+H2O,反应中氧化剂与还原剂物质的量之比为1:1,此反应可以用来吸收实验中多余的氯气,也可以用来制备漂白液。
35.漂白液的主要成份是NaCl、NaClO,有效成份是NaClO。
36.常温时3Cl2+6NaOH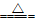 5NaCl+NaClO+3H2O,反应中氧化剂与还原剂物质的量之比为5:1。
5NaCl+NaClO+3H2O,反应中氧化剂与还原剂物质的量之比为5:1。
37.工业通常是将Cl2通入石灰乳中用来制取漂白粉,不能用澄清石灰水,因为Ca(OH)2的溶解度太小,溶质太少,不利于生产。
38.制漂白粉化学方程式:2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O。
漂白粉的主要成份是CaCl2、Ca(ClO)2,有效成份是Ca(ClO)2,漂粉精是纯度更高的漂白粉。
39.漂白粉漂白原理:Ca(ClO)2 + H2O + CO2===CaCO3↓ + 2HClO,反应原理为:强酸制弱酸,用盐酸也能反应,所以适当增强酸性利于增强漂白性,酸太太强,会生成Cl2而使HClO损失。
40.漂白粉失效原理:Ca(ClO)2 + H2O + CO2===CaCO3↓ + 2HClO,2HClO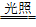 2HCl
+ O2↑,
2HCl
+ O2↑,
CaCO3+2HCl===CaCl2+H2O+CO2↑,由上述反应知,漂白粉应密封,低温避光保存。
41.漂白液、漂白粉、漂粉精既可作漂白棉、麻、纸张的漂白剂,又可作游泳池及环境的消毒剂
42.84消毒液(NaClO)和洁厕灵(HCl)不能混用(ClO-+ Cl-+2H+===Cl2↑+H2O)
43.向Ca(ClO)2溶液中通入CO2气体,之后沉淀生成,后沉淀消失。
Ca(ClO)2 + H2O + CO2 = CaCO3↓ + 2HClO;CaCO3 + H2O + CO2 = Ca(HCO3)2
44.向Ca(ClO)2溶液中通入SO2气体生成的是CaSO4,其离子方程式为:
Ca2++ 3ClO-+ SO2 + H2O===CaSO4↓ + Cl-+ 2HClO
45.向NaClO溶液中通入少量SO2气体,其离子方程式是3ClO-+ SO2 + H2O = SO42-+ Cl-+ 2HClO
向NaClO溶液中通入过量SO2气体,其离子方程式是ClO-+ SO2 + H2O = SO42-+ 2Cl-+ 2H+
46.Cl2还能与很多还原性物质反应
①Cl2与FeCl2溶液反应:Cl2+2FeCl2===2FeCl3 (除去FeCl3中FeCl2)
②Cl2与KI溶液反应:Cl2+2KI===2KCl+I2 (氯气的检验:湿润的淀粉碘化钾试纸变蓝)
③Cl2与SO2的水溶液反应:Cl2+SO2+2H2O===2HCl+H2SO4
④与Na2S反应:Cl2+Na2S===2NaCl+S↓ Cl2+H2S===2HCl+S↓ (氧化性:Cl2﹥S)
⑤与H2O2反应:Cl2+H2O2===2HCl+O2
⑥与NH3反应:8NH3+3Cl2===N2+6NH4Cl (检验输氯管道是否发生泄漏)
47.1774年,瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)时,把浓盐酸与软锰矿混合在一起加热,发现有黄绿色气体生成,反应为
4HCl(浓)+MnO2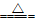 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
48.实验室制Cl2,除了用MnO2和浓HCl加盐反应制备外,还可以用KMnO4、KClO3与浓HCl反应,且不需要加热。
2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O;
KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O;
49.MnO2和浓盐酸反应,盐酸体现酸性和还原性,若在某一反应中,形成了对应的盐,则该酸体现酸性,即硫酸参加反应,生成了硫酸盐,盐酸参与反应,生成了盐酸盐。
50.MnO2和浓盐酸在加热情况下生成Cl2,但随反应进行,浓盐酸变稀,MnO2与HCl反应停止。
51.实验室制取氯气必须用浓盐酸,MnO2与稀盐酸不反应,且随着反应的进行,盐酸浓度变小,无论MnO2是否足量,盐酸均不能完全反应,反应后的溶液为盐酸和MnCl2的混合液
52.实验室制取氯气是采用固体和液体混合加热制气体的装置,主要有气体的发生装置、净化除杂装置、干燥装置、收集装置和尾气处理装置
53.气体净化装置设计必须同时考虑主要成分和杂质成分的性质,以便选择适当的装置除去杂质。
54.用浓盐酸和MnO2制取Cl2时,混有的杂质气体主要是浓盐酸挥发出来的HCl气体和水蒸气。除杂的先后顺序:先除HCl气体,再除水蒸气。
55.除去Cl2的HCl气体可以用饱和食盐水,原因为 Cl2+H2O⇌HCl+HClO,饱和食盐水中高浓度的Cl-,降低了Cl2在水的溶解度。
56.氯气有毒,在制备氯气及做相关实验时要注意安全,应在通风橱中进行。
57.Cl2有毒,必须有尾气吸收装置,常用吸收剂为NaOH溶液或碱石灰,不用澄清石灰水
58.实验后剩余的氯气常用NaOH溶液吸收,由于Cl2在NaOH中扩散较慢,教材中并未防倒吸。
59.为了减少制得的Cl2中HCl的含量,加热温度不宜过高,减少HCl的挥发。
60.实验结束后,先使反应停止并排出装置中残留的Cl2,再拆卸装置,避免污染空气
61.将湿润的淀粉碘化钾试纸靠近盛氯气的瓶口,观察到试纸立即变蓝,则说明氯气已收集满。
62.将湿润的蓝色石蕊试纸靠近集气瓶口,若试纸先变红后褪色,则说明氯气已收集满。
63.HCl是一种无色有剌激性气味的气体,有毒,极易溶于水(1:500) 。
64.100个Cl2与足量的铁反应,得到的电子数为200个。
65.100个Cl2与足量的NaOH反应,得到的电子数为100个。
66.100个Cl2与水反应,得到的电子数小于100个,因为此反应为可逆反应,不会进行彻底。
67.工业上氯气的制备:在工业上用电解饱和食盐水的方法来制取氯气(氯碱工业)。
2NaCl + 2H2O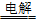 2NaOH + Cl2↑+
H2↑(用离子交换膜,阻止Cl2与NaOH、H2接触)
2NaOH + Cl2↑+
H2↑(用离子交换膜,阻止Cl2与NaOH、H2接触)

- 全部评论(0)
