如何正确书写电极反应方程式?
时间:2017-04-25 19:13 来源: 作者:鲁群 点击: 次 所属专题: 电极反应式
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一. 电解质溶液酸碱性关系
酸性介质中,有![]() 或H2O参与或生成,电极反应式中不会出现
或H2O参与或生成,电极反应式中不会出现![]() ;碱性介质中,有
;碱性介质中,有![]() 或H2O参与或生成,电极反应中不会出现
或H2O参与或生成,电极反应中不会出现![]() 。
。
例1. 写出氢氧燃料电池在酸性和碱性电解质溶液中的电极反应方程式。
解析:其电池反应均为![]()
酸性介质中:负极:![]()
正极:![]()
碱性介质中:负极:![]()
正极:![]()
二. 电极材料的关系
无论是原电池还是电解池,阳极上总是发生氧化反应,阴极总是发生还原反应。在电极上谁应优先参与放电发生电极反应呢?其实这与一般氧化还原反应直接进行的道理完全一样,也就是看谁的氧化性或还原性最强(考虑对象包括除惰性电极以外的电极材料、电极区内的溶液中离子,甚至氧化物、难溶盐等物质)谁就优先参与电极反应。所以,阴极反应就考虑谁最容易得到电子,阳极反应就考虑谁最容易失去电子。
例2. 写出用铜作电极电解硫酸铜溶液的电极方程式、总反应方程式;再写出用石墨电极电解硫酸溶液的电极方程式、总反应方程式。
解析:以铜作电极材料电解时,显然在阳极区铜最容易失去电子,在阴极区以![]() 得到电子的能力最强。故有阳极
得到电子的能力最强。故有阳极![]() ,阴极
,阴极![]() 。
。
二者相加可得总电解方程式得:Cu(粗)=Cu(电解铜),这就是铜的精炼。
石墨是惰性电极,不参与电极反应,仅考虑电解质溶液中离子(包括考虑浓度)的放电顺序。阳极(石墨):![]() 。
。
阴极(石墨):![]()
二者相加得总电解方程式得:![]()
三. 蓄电池的充电与放电关系
可充电电池(蓄电池)放电时相当于原电池,充电时相当于电解池。蓄电池放电时的电极反应与其充电时的电极反应也互为可逆(化学)反应。
例3. 高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
![]()
则放电时正极电极方程式为:__________________;负极方程式为:______________。充电时阳极方程式为:________________;阴极方程式为_________________。
解析:已知原电池反应,欲写出其电极反应的最直接简便的方法,就是将该原电池反应分解为“氧化”和“还原”两个“半反应”
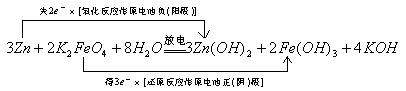
然后,将这两个“半反应”配平即可:原电池放电时负(阳极):
![]()
正(阴)极:
![]()
你发现了吗?上述正(阴)极反应还可由原电池反应减去负(阳)极反应直接、迅速获得。搞清楚道理,就能条条道路通罗马。
充电时相当于电解池,显然电解反应就是该原电池反应的逆反应。所以电解(充电)时的电极反应也必定就是该原电池电极反应的逆反应,故又可迅速写出电解池的阴(负)极反应为![]() ;阳(正)极反应为
;阳(正)极反应为![]() (注意:由题知该电池为碱性电池,故电极反应配平时可加
(注意:由题知该电池为碱性电池,故电极反应配平时可加![]() 、
、![]() ,但不得出现
,但不得出现![]() )。
)。

- 全部评论(0)
(3366127464) 评论 href="/plus/view.php?aid=4015">如何正确书写电极反:挺好的,内容确实比较充分有效。。。。。。。。。。。。。。
(3366127464) 评论 href="/plus/view.php?aid=4015">如何正确书写电极反:挺好的,内容确实比较充分有效
