摩尔气体常数的测定
时间:2019-11-19 17:28 来源: 作者:张县 点击: 次 所属专题: 气体状态方程
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
定义:
摩理想气体在标准状况下的P0V0/T0值,叫做摩尔体积常数,简称气体常数。符号 R
R=(8.314510 ![]() 0.000070)J/(mol••••K)。
0.000070)J/(mol••••K)。
它的计算式是
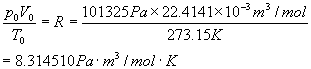
原理:
用已知质量的镁条跟过量的酸反应产生氢气。把这氢气的体积、实验时的温度和压强代入理想气体状态方程(PV=nRT)中,就能算出摩尔气体常数R的值。氢气中混有水蒸气,根据分压定律可求得氢气的分压(p(H2)=p(总)-p(H2O)),不同温度下的p(H2O)值可以查表得到。
操作:
(1)精确测量镁条的质量
方法一:用分析天平称取一段质量约10mg的表面被打亮的镁条(精确到1mg)。
方法二:取10cm长的镁带,称出质量(精确到0.1g)。剪成长10mm的小段(一般10mm质量不超过10mg),再根据所称镁带质量求得每10mm镁条的质量。
把精确测得质量的镁条用细线系住。
(2)取一只10 mL小量筒,配一单孔塞,孔内插入很短一小段细玻管。在量筒里加入2~3mL6mol/L硫酸,然后十分仔细地向筒内缓慢加入纯水,沾在量筒壁上的酸液洗下,使下层为酸,上层为水,尽量不混合,保证加满水时上面20~30mm的水是中性的。
(3)把系有细线的镁条浸如量筒上层的水里,塞上带有玻璃管的橡皮塞,使塞子压住细绳,不让镁条下沉,量筒口的水经导管口外溢。这时量筒中和玻璃导管内不应留有气泡空隙。
(4)用手指按住溢满水的玻璃导管口,倒转量筒,使玻璃导管口浸没在烧杯里的水中,放开手指。这时酸液因密度大而下降,接触到镁带而发生反应,生成的氢气全部倒扣在量筒内,量筒内的液体通过玻璃导管慢慢被挤到烧杯中。
(5)镁条反应完后再静置3~5分钟,使量筒内的温度冷却到室温,扶直量筒,使量筒内水面跟烧杯的液面相平(使内、外压强相同),读出量筒内气体的体积数。由于气体的体积是倒置在量筒之中,实际体积要比读数体积小约0.2mL,所以量筒内实际的氢气体积V(H2)=体积读数-0.20mL(用10mL的量筒量取)
(6)记录实验时室内温度(t℃)和气压表的读数(p大气)。
计算
(1)根据化学方程式和镁条的质量算出生成氢气的物质的量(n(H2))
(2) 按下列步骤计算氢气在标准状况下的体积。
查表得到室温下水的饱和蒸气压(p(H2O)),用下式计算氢气的分压(p(H2))
![]()
根据下式
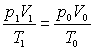
把 ![]() , T1=273+t, p0=100Kpa, T0=273K代入上式,得到标准状况下氢气的体积是
, T1=273+t, p0=100Kpa, T0=273K代入上式,得到标准状况下氢气的体积是
![]()
因此,摩尔体积常数(R)是
![]()

- 全部评论(0)
