“摩尔日”与阿伏加德罗
时间:2016-01-17 11:07 来源:未知 作者:吴乾环 点击:次 所属专题: 阿伏伽德罗常数
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
10月23日是什么纪念日?这问题,恐怕绝大多数人都回答不上来。细心的人或许还会去翻翻日历,寻个究竟。一条微博揭示了真相:“10月23日早晨6:02到傍晚6:02间属于‘摩尔日’,一起来纪念当年的意大利化学家阿伏加德罗……”
“你曾经对我说,10月23是摩尔日,摩尔这东西我明白,但摩尔日是什么?”本着“内事不决问百度,外事不决问谷歌”的精神,我上网搜了一下,终于弄明白:“摩尔日是一个流传于北美化学家间的非正式节日,通常他们在10月23日的上午6:02到下午6:02之间庆祝。”
物质的量是国际单位制中7个基本物理量之一,摩尔是物质的量的单位。1 摩尔任何物质中都含有阿伏加德罗常数个微粒,而阿伏加德罗常数的近似值为6.02×10∧23。根据阿伏加德罗常数的数值,10月23日就成了“摩尔日”,而6.02更是被创造性地移植成6:02。
化学是一门严谨的科学,但化学绝不是刻板的代名词。既然周其凤校长都能高歌一曲《化学是你,化学是我》,网友们以这样娱乐化的庆祝方式纪念“摩尔”倒也并无不可。至少,它让更多的人了解了“摩尔”以及阿伏加德罗。
“阿伏加德罗常数”以阿伏加德罗冠名,但阿伏加德罗并非该常数的所有者。阿伏加德罗(Ameldeo Avogadro,1776~1856)是意大利著名的物理学家、化学家,他的最大贡献,是提出了分子假说。
一、阿伏加德罗与分子假说
分子是构成物质的一种微粒,这在现在是众所周知,不过,这一理论的提出、并被人们接受,经历了漫长而曲折的过程。
19世纪初期,英国化学家约翰·道尔顿在他的皇皇巨著《化学哲学的新体系》中,阐述了他的原子论,其中的要点主要有三方面:①元素都是由非常微小的、不能再分的微粒组成,这种微粒称为原子。原子在一切化学变化中都不能再分。②同种元素的所有原子,其质量和性质是相同的;不同元素的原子,其质量和性质都不相同。原子的质量是元素的基本特征之一。③不同的元素化合时,这些元素的原子按简单整数比结合成化合物。化合物的原子是复杂原子,其质量等于组成它的各原子的质量之和。
尽管无法亲眼看到原子,很多信奉眼见为实的科学家还将信将疑,但原子论的确能完美地解释当时的许多科学事实——比方说质量守恒定律、倍比定律等——所以很快就被主流的科学所接受。只是,道尔顿的原子论刚火热了没多久,就有人来“砸场子”了。此公就是法国化学家盖·吕萨克。
盖·吕萨克一生建树众多,涉足的研究领域也很广,而他有一个最大的优点,即酷爱实验,而且精于实验。他的许多研究成果,直接来源于他的精确的实验。1809年,在对大量气体反应进行测定的基础上,盖·吕萨克在他的那篇著名论文《论气体物质彼此化合》中总结出了一条经验规律:当气体互相化合时,各气体的体积成简单的整数比(当然,需要在同温同压下)。
大量的气体化合反应(其实不仅仅是化合反应)都支持这一规律。比方说,氢气与氧气化合成水蒸气时,其体积比为2∶1∶2;氢气和氯气化合成氯化氢气体时,其体积比为1∶1∶2;氮气与氢气化合成氨气时,其体积比为1∶3∶2。这样的例子举不胜举,再写下去有骗取稿费的嫌疑了,打住。
而同时,盖·吕萨克为配合原子论,提出了“在同温同压下,相同体积的不同气体含有相同数目的原子”这一假设。按常理说,气体化合反应,各气体体积成简单整数比,是对道尔顿的原子学说——不同的元素化合时,这些元素的原子按简单整数比结合成化合物——的一个强有力的证明,理应得到道尔顿的认可和推崇。不想,马屁拍在了马脚上,道尔顿一点也不领情,反而认为盖·吕萨克是在拆他的台。
下面就以氢气与氧气化合成水蒸气这一反应为例。2体积氢气与1体积氧气化合生成2体积水蒸气,可以推论得到2个氢原子与1体积氧原子反应得到2个水蒸气原子(道尔顿称其为复杂原子)。
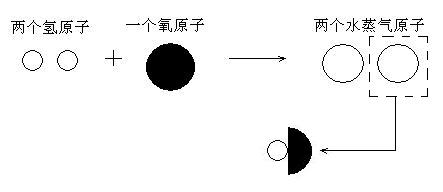
很明显,如果反应是照左图所示进行的话,那么每一个水蒸气原子,必然是由一个氢原子和半个氧原子组成的!半个氧原子,开玩笑,“原子是构成物质的最小微粒、不可再分”可是道尔顿原子论的核心!“把原子劈开,你好大的胆子!”(此处为杜撰的道尔顿的心理描写)而事实上,根据盖·吕萨克的实验,不仅要一分为二,有些反应中原子甚至要一分为三……谅道尔顿脾气再好,也无法接受这一切。况且他的脾气并不咋地。
分歧之下,盖·吕萨克自然坚持己见。有点恼羞成怒的道尔顿指责盖·吕萨克的实验可能做得不准确,导致实验数据有误。这玩笑开得有些大了,说盖·吕萨克做实验不严谨,就类似于说关云长武功差、博尔特跑得慢、爱因斯坦不聪明、比尔盖茨穷光蛋一般。
为了调和道尔顿和盖·吕萨克的矛盾,阿伏加德罗“粉墨登场”,抛出了他潜心研究得出的理论——分子假说。
阿伏加德罗认为:第一,气体并非由原子直接构成,而是由分子构成。分子是构成气体的基本结构单元。气体单质大多数是双原子分子,如氢分子由两个氢原子组成,氧分子由两个氧原子组成,氮分子由两个氮原子组成(当然也有例外)。气体化合物则是由不同的原子构成分子。第二,同温同压下,同体积的任何气体都含有相同数目的分子(这后来被称为阿伏加德罗定律)。
这样一来,氢气与氧气化合成水蒸气的反应中的死结就迎刃而解。即氢分子由两个氢原子组成,氧分子由两个氧原子组成,水蒸气分子由两个氧原子和一个氢原子组成。如下图所示:
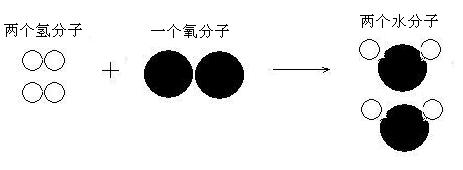
这样即没有让原子莫名其妙地分裂,氧原子的一半,永远还是另一半“不可分割的一部分”,而同时也能完美地吻合盖·吕萨克的实验结果。不料,这个论断虽然帮得了道尔顿和盖·吕萨克,却得不到大多数科学家的认可。因为分子这玩意儿,以当时的认知,是不可能存在的。当时正是贝采利乌斯的“电化二元论”盛行之时。“电化二元论”认为:每个原子都带有正负两种电荷,例如氧原子有极强的负电性,金属原子(如钾原子)有极强的正电性。化学反应,其实是正负电荷之间的相互吸引。(电化二元论的核心内容还有很多,此处不展开)两个同样带负电性的氧原子结合在一起构成分子,是难以想象的。电化二元论能比较完美地解释电解反应、酸碱中和反应等过程,又很容易理解和接受,所以风靡一时。但电化二元论也有其局限性,在同种原子能否构成分子这个问题上,电化二元论纯属“误导”。(直至20世纪初期,美国化学家路易斯创立了共价键理论,揭示了原子间通过共用电子对构成分子的方式,才比较好地解释了气体单质分子是如何构成的)
科学往往是这样。某些事实超出当时科学家们的认知范畴,就会被认为是不合理的,只有经过科学技术不断发展,认知不断进步,才会逐渐闪烁出其光芒。又如,卢瑟福通过α粒子散射实验,确定了带正电荷的质子集中于原子中心极其小的体积内(原子核内)。不过,那些带正电的质子被束缚在空间极其狭小的原子核内,按当时经典物理学的理论来看,一定是不稳定的。但原子并没有因此而时不时地“自爆”,相反,大多数原子都寿命极长。或许,人的一生对于原子而言,只是打个哈欠而已。
言归正传。真理有时候会被埋没很长时间,但终究会被重新发掘出来,并大放异彩。阿伏加德罗的分子假说没人在意,但科学界的矛盾却日益加剧。因为对于气体物质构成的错误认识,使得原子量的测定的数值、物质的表示方式极其混乱,每个人都自成一套体系,并不买其他人的账。
真相就要大白于天下了。在1860年德国卡尔斯鲁厄召开的国际化学会议上,散发了一本由意大利化学家康尼查罗写的名叫《化学哲学教程提要》的册子。这本册子就阿伏加德罗的分子假与盖·吕萨克的气体化合定律的关系进行了阐述,据理力争说明了分子假说具有坚实的实验基础;而更多实验事实(如有机取代反应)证明了电化二元论有比较大的局限性,原来横亘在分子学说面前的大山被搬开;同时,康尼扎罗还根据分子假说测定了不少化合物的相对分子质量,在此基础上,指出了测定相对原子质量的合理的方法,并确立了书写化学式的原则。《化学哲学教程提要》厘清了当时存在的一系列模糊和错误的认识,顿时使许多问题豁然开朗。自此,分子假说成为了分子学说,人们对物质微观世界的认识也由此前进了一大步。
时至今日,没有人会怀疑分子的存在,布朗运动为你揭示了分子的热情与活力,而借助于STM,更是能够一睹分子的风采。但我们仍应看到,分子假说的建立经历了太多的曲折。其最终的胜利,亦是来之不易。
二、摩尔与阿伏加德罗常数
在学数理化的过程中,经常接触到各种定理、定律、单位,这其中很多都是由科学家的名字来命名的。比如说:牛顿定律,欧姆定理,薛定谔方程,压强的单位是帕斯卡,功率的单位是瓦特。
摩尔是物质的量的单位。叫摩尔的名人可不少,英特尔公司创始人之一戈登·摩尔就提出了揭示了信息技术进步的速度的摩尔定律。黛米·摩尔则是美国著名影星,出演了《人鬼情未了》等名作。不过物质的量的单位摩尔,可不是以哪个科学家的名字来命名的,它源于拉丁文mole,表示大量、堆积的意思。
1971年10月,第14届国际计量大会决定增加摩尔作为第七个国际单位制的基本单位。大会定义了:“摩尔是一系统的物质的量,该系统中所包含的基本单元数与0.012kg碳—12的原子数目相等。”“在使用摩尔时应予以指明基本单元,它可以是原子、分子、离子、电子及其他微粒,或是这些微粒的特定组合。”物质的量为1摩尔物质,所含基本单元的数目,即0.012kg碳—12中所包含碳原子的数目,称之为阿伏加德罗常数。
阿伏加德罗常数,当然不是因为由阿伏加德罗测定得到而得名。这来自于法国物理学家让·巴蒂斯特·皮兰。也许是出于对阿伏加德罗的崇敬,皮兰提议用阿伏加德罗数这个名称(后来改成阿伏加德罗常数),来表示1克分子氧气(约32克)中所含有的氧分子数。(克分子是以前所使用的一个定义,当物质以克为单位计量质量的数值等于其相对分子质量时,该些物质就是1克分子,等同于现在所说的1摩尔)。同时,皮兰还致力于用科学实验测定阿伏加德罗常数的值,并因为这些研究而获得了1926年诺贝尔物理学奖。
阿伏加德罗常数因为能将宏观(比如质量、体积等物理量)与微观(即所含的分子数)等联系起来,所以在科学研究上是一个很有用的常数。所以,精确测定阿伏加德罗常数意义重大,也是一些科学家孜孜不倦研究的方向。
那么,阿伏加德罗常数是如何得到的呢?拍脑袋想当然是想不出来的。那么,制取1摩尔氧气,然后一个一个地数分子?别吐槽了,我只是开个玩笑罢了。阿伏加德罗常数的测定方法大致有布朗运动法、油滴法、电量分析法、X射线晶体密度法等等。如果你有兴趣的话,自己在实验室里也可以测定阿伏加德罗常数。
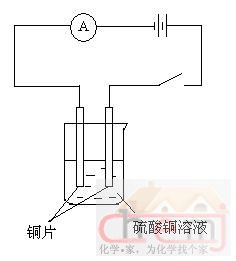
按图示装置连接,进行反应,就可以测定阿伏加德罗常数。需要记录的数值有:电流强度I、电解的时间t、阳极铜片反应后质量的减少值△m(或阴极铜片反应后质量的增加值△m)。然后根据公式NA=63.5It /(2×1.6×10-19×△m)即可计算得到阿伏加德罗常数。其中63.5是铜的相对原子质量,1.6×10-19是电子的电量。当然,要想精确地完成这个实验,并不是那么简单的。比方说,电路中需要连接一个滑动变阻器,以保证电解过程中电流强度保持恒定;铜片在电解前需要进行预处理,电解后称量前也要进行处理,并要确保称量的精确;电流要进行控制,电流太大的话,阴极铜沉积疏松,不利于称量,等等。当然,受制于实验仪器测量精度的限制,该实验即使进行得再完美,得到的阿伏加德罗常数也会有比较大的误差。
目前国际上最精确地测定阿伏加德罗常数的方法当属X射线晶体密度法。该方法采用单晶硅球作为测定对象。其计算的依据很简单,即NA=单晶硅球的摩尔体积/平均每个硅原子的体积。没看错吧,就那么简单:数量=总体积/单位体积。不过,实际的测定过程,却是异乎寻常地“高标准严要求”。
首先,对单晶硅球的要求极高,要求单晶硅球的杂质含量极少、晶体结构几乎没有缺陷(或者缺陷极少)。当然,完全不含杂质和没有结构缺陷是不可能的,所以就要对单晶硅球的杂质含量和结构缺陷进行分析,了解不同的杂质含量和结构缺陷对单晶硅球密度的影响,这样才能精确地测定得到单晶硅球的密度。第二,如何测定1摩尔硅球的体积,也是很关键的。理论上来说,硅球的摩尔体积=硅的摩尔质量/硅球的密度,而硅的摩尔质量与其相对原子质量在数值上相等。硅的相对原子质量不是28(实际计算时应取精确值)吗?这当然没错,但放在如此精确的测定实验中,就有问题了。这是因为硅有三种天然同位素,Si-28,Si-29,Si-30,硅的相对原子质量取决于这三种同位素在硅材料中的相对含量。因此,精确测定硅的相对原子质量,“看上去很美”,实则艰难异常,目前仍是制约阿伏加德罗常数测定精度的瓶颈之一。第三,测定平均每个硅原子的体积,实际上是测定硅晶体每个晶胞的体积,然后根据平均每个晶胞中含有的硅原子数(8个),折算出每个硅原子的体积。实际测定时,通过X射线衍射来测定硅晶体的晶格常数,进而得到单个晶胞的体积。
测定得到了单晶硅球的密度、硅的相对原子质量(摩尔质量)及单个晶胞体积,可以很方便地求算出阿伏加德罗常数的值。根据“国际阿伏加德罗协作组织”2011年发布的数据,阿伏加德罗常数最新的测量数值为 6.02214078(18)×1023mol-1。从历史发展来看,这个数据已经相当精确了。不过,就像大多数科学研究一样,只有更精确,没有最精确,不是吗?

- 全部评论(0)
