元素周期表中位、构、性的规律
时间:2020-02-19 09:46 来源: 作者:赵亭 点击: 次 所属专题: 元素周期表规律 位构性
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、位——元素在周期表中位置的规律
1. 各周期最后一种元素(即稀有气体元素)核电荷数为2、10、18、36、54、86、(118);
2. 周期表纵行行序数与主族族序数关系:1——IA、2——IIA、13——IIIA、14——IVA、15——VA、16——VIA、17——VIIA、18——0族。
3. IIA与IIIA的同周期元素核电荷数之差(△Z):二、三周期——△Z=1;四、五周期——△Z=11;六、七周期——△Z=25;
4. 相邻周期同一主族元素核电荷数之差(△Z):
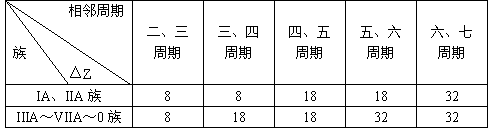
5. 电子层结构相同的离子,若电性相同,则位于同周期,若电性不同,则阳离子位于阴离子的下一周期;
6. 由原子序数确定元素位置的规律。
基本公式:原子序数-稀有气体元素核电荷数[10(二周期)、18(三周期)、36(四周期)、54(五周期)、86(六周期)]=差值。
(1)对于18号以前的元素,有两种情况:
①若0<差值≤7时,元素在下一周期,差值为主族序数;
②若差值为0,一定为零族元素;
(2)对于19号以后的元素分三种情况:
①若差值为1~7时,差值为族序数,位于VIII族左侧;
②若差值为8、9、10时,为VIII族元素;
③若差值为11~17时,再减去10最后所得差值,即为VIII族右侧的族序数。
二、构——元素原子结构(包括电子层数、最外层电子数、质子数、中子数、各层电子数之间的关系)的规律
1. 原子序数=原子核内的质子数=中性原子的核外电子数=核电荷数
质量数=质子数+中子数;
2. 周期序数=原子核外的电子层数
主族族序数=最外层电子数(即价电子数)=最高正价(O、F除外);
3. 最高正价+|负价|=8;
4. 次外层电子数为2的元素为第二周期元素;
L、M层电子数都是8的元素为![]() ;
;
5. 最外层电子数为2的元素,可能是IIA族元素,也可能是副族或VIII族(Fe)或零族元素(He);
6. 族序数等于周期数的元素:![]() ;
;
族序数等于周期数2倍的元素:C、S;
族序数等于周期数3倍的元素:O;
周期数是族序数2倍的元素:Li;
周期数是族序数3倍的元素:Na;
7. 正负化合价代数和等于(即绝对值之差)

三、性——元素及其化合物的性质(包括元素的金属性和非金属性,元素的化合价、元素原子半径大小、元素单质与氢化或置换氢能力强弱等性质)的规律
1. 同周期元素从左到右(同主族元素从上到下与此相反)
(1)原子半径逐渐减小;
(2)非金属性逐渐增强,金属性逐渐减弱;
(3)气态氢化物稳定性逐渐增强;
(4)最高价氧化物对应的水化物酸性逐渐增强,碱性逐渐减弱。
2. 最强的含氧酸是高氯酸(![]() ),最强的无氧酸为氢碘酸(HI),最弱的无氧酸为氢氟酸(HF)。
),最强的无氧酸为氢碘酸(HI),最弱的无氧酸为氢氟酸(HF)。
3. 既能与酸反应又能与碱溶液反应可产生![]() 的金属元素为铝(Al),与碱溶液反应可产生
的金属元素为铝(Al),与碱溶液反应可产生![]() 的非金属元素为硅(Si),
的非金属元素为硅(Si),![]() 和
和![]() 都有两性。
都有两性。
4. 其氢化物能腐蚀玻璃的元素为氟(F)。
5. 最高价氧化物对应的水化物可与其氢化物起化合反应的元素为氮(N),能起氧化还原反应的元素为硫(S)。
6. 形成化合物种类最多的元素、单质是自然界中硬度最大的物质的元素、气态氢化物中氢的质量分数最大的元素是碳(C)。
7. 空气中含量最多的元素或气态氢化物的水溶液呈碱性的元素是氮(N)。
8. 地壳中含量最多的元素或氢化物在通常情况下呈液态的元素是氧(O)。
9. 地壳中含量最多的金属元素是铝(Al)。
10. 元素的气态氢化物和它的氧化物在常温下反应生成该元素单质的元素是硫(S)。
11. 元素的单质在常温下能与水反应放出气体的短周期元素是锂(Li)、钠(Na)、氟(F)。
12. 常见的能形成同素异形体的元素有碳(C)、磷(P)、氧(O)、硫(S),其中一种同素异形体易着火的元素是磷(P)。
13. 最活泼的非金属元素、无正价的非金属元素、无含氧酸的非金属元素、无氧酸可腐蚀玻璃的元素、气态氢化物最稳定的元素、阴离子的还原性最弱的元素是氟(F)。
14. 最活泼的金属元素、最高价氧化物对应的水化物碱性最强的元素、阳离子氧化性最弱的元素是铯(Cs)。

- 全部评论(0)
