化学汉字:氨·胺·铵·磷·膦·鏻
时间:2022-08-13 08:17 来源: 作者:朱照鹰 点击: 次 所属专题: 磷元素 氮及其化合物
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
这是一组对比性很强的知识。通过氮、磷及其化合物的结构和性质的对比、辨析,能在开阔知识面的同时,强化对元素周期律的理解,提高类比、迁移、创新的能力。
一、氨、胺、铵
1.氨 化学式为NH3,是三角锥形(键角107°18′)的强极性分子,氮原子上还有一对孤对电子。通常情况下,氨是无色有刺激性气味、比空气轻的易液化、易溶于水的气体,易与酸反应,具有一定的还原性。氨的分子结构、物理性质、化学性质、实验室制法和工业合成、以及氨的用途都是重要的知识点。
![]()
![]() “胺”,通式R—NH2。
“胺”,通式R—NH2。
![]()

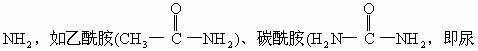 素)等。
素)等。


![]()
铵盐类似于碱金属的盐类,一般是无色晶体,易溶于水。铵盐的“三解”——溶解(于水)、热解(受热分解)、碱解(与碱在固相或溶液中共热产生NH3)是其重要的性质,也是重要的考点。
二、磷、膦、鏻
1.磷 指磷元素的单质,有多种同素异形体,其中常见的是白磷和红磷。白磷(遇光渐变黄色,又称黄磷)为正四面体结构(键角60°),化学式为P4,不溶于水易溶于CS2,有剧毒,着火点是40℃。因易被氧化而被保存在水中(实验室里),工业上用于制高纯度的磷酸。红磷是一种暗红色粉末,不溶于水,也不溶于CS2,无毒,着火点是240℃,用于制农药和安全火柴。白磷与红磷的相互转化关系为:
![]()
此转化属于化学变化。
2.膦 磷与氢组成一系列氢化物PH3、P2H4、P12H16等,其中最重要的是PH3,称为膦。磷与氢气难于直接化合,故膦由间接方法——白磷与碱共热制得:
P4+3KOH+3H2O![]() 3KH2PO2(次磷酸钾)+PH3↑
3KH2PO2(次磷酸钾)+PH3↑
或由Ca3P2水解制得:Ca3P2+6H2O====3Ca(OH)2+2PH3↑
PH3是无色有剧毒的气体,有类似大蒜的臭味。由NH3迁移到PH3,知二者既相似又有差异:
(1)PH3的分子结构与NH3相似,为三角锥形(但键角为93°);
(2)PH3的极性比NH3弱;
(3)PH3在水中的溶解度比NH3小得多(25℃时,100体积水仅溶解26体积的PH3);
(4)PH3水溶液的碱性比氨水弱;
(5)PH3稳定性较NH3差;(4PH3![]() P4+6H2)
P4+6H2)
(6)PH3的还原性比NH3强(着火点仅为50℃,可在空气中自燃:PH3+2O2====H3PO4)。
![]()
碱性弱,PH4X不能在溶液中生成、可由膦与HX气相化合制得:PH3+HX(g)====PH4X(S)
同样,鏻盐与铵盐既相似又有差异:
(1)与碱反应生成PH3。如:PH4I+NaOH====NaI+PH3↑+H2O,(亦是制PH3方法之一)
(2)热稳定性差。卤化鏻中PH4Cl、PH4Br常温即分解,较稳定的是PH4I,但受热仍分解:
PH4I![]() PH3+HI,因PH3、HI均不稳定,故可发生连锁分解:
PH3+HI,因PH3、HI均不稳定,故可发生连锁分解:
4PH4I![]() P4+2I2↑+8H2↑,
P4+2I2↑+8H2↑,
![]()
PH4I+H2O====PH3+H3O++I-

- 全部评论(0)
