怎样确定复杂原子的核外电子分层排布
时间:2022-08-05 17:40 来源:摘抄于因特网 作者:李萱 点击: 次 所属专题: 核外电子分层排布
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、电子层容量原理
在原子核外电子排布中,每个电子层最多容纳的电子数为2n2,这个规律在一些无机化学教材中叫做最大容量原理。我认为,该原理并不能全面反映原子核外电子排布的真实情况,
其一,它只适合于离核近的内电子层,且不是最大,而是等于2n2;
其二,离核远的外电子层,实际排布的电子数则远远小于2n2,根本不能用此原理来描述。离核近的内电子层与离核远的外电子层,各有其电子容量的规律,原子的电子层排布,就是这两种规律结合而成的。
为此,我总结出内电子层和外电子层的各自的容量规律,并将两者结合起来,称为“电子层容量原理”,其内容如下:
设w为原子的电子层数,n为从原子核往外数的电子层数,m为由原子最外层往里数的电子层数。
当n<![]() 时,为内电子层,每个电子层容纳的电子数=2n2。
时,为内电子层,每个电子层容纳的电子数=2n2。
当n≥![]() 时,为外电子层,每个电子层最多容纳的电子数=2(m+1)2。
时,为外电子层,每个电子层最多容纳的电子数=2(m+1)2。
核外只有k层时,最多容纳2个电子。
由上述两个关系组成的电子层排布如下:
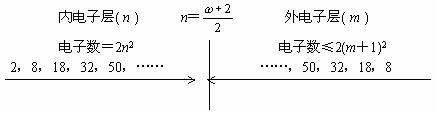
从以上图示可知,原子的电子排布是两头少,中间多。
应用电子层容量原理,可使外电子层不用2n2,避免出现太大偏差。
应用外电子层的公式,可以取代中学教材中的如下规律:
(1) 最外层电子数不超过8个(最外层为K层,则不超过2个)。
(2) 次外层电子数不超过18个。
(3) 外数第三层电子数不超过32个。……
因为这些规律可直接从外电子层的公式推出。
稀有气体原子的电子层排布则是很规整的相等关系,其内电子层电子数为2n2,外电子层电子数为2(m+1)2,因此,稀有气体元素原子的电子层结构是一种稳定结构。主族元素的原子,最外层未达到2(m+1)2个电子(即8个电子),一般副族元素的原子,最外层和次外层的电子数均小于2(m+1)2。原子的电子层数越多,出现未填满电子数2(m+1)2的外电子层数就越多。它可用下式计算:未排满2(m+1)2个电子的电子层数最多为![]() (当为偶数)或
(当为偶数)或![]() (为奇数)。例如:核外有6个电子层的元素,没有排满2(m+1)2个电子的外电子层数最多为
(为奇数)。例如:核外有6个电子层的元素,没有排满2(m+1)2个电子的外电子层数最多为![]() =3。镧系元素的原子,一般就有4、5、6三个电子层的电子数未达到2(m+1)2。
=3。镧系元素的原子,一般就有4、5、6三个电子层的电子数未达到2(m+1)2。
2n2是由电子运动状态的四个量子数及泡利不相容原理所得出的关系,而2(m+1)2却是由能级交错现象所得出的关系。
对于多电子原子,由于电子的屏蔽作用和穿透作用,出现了原子轨道的交错现象,产生了与元素周期表中周期相对应的能级分组,能级组的通式为ns、(n-2)f、(n-1)d、np。从第3电子层起,出现End>E(n+1)s,从第4电子层起,出现Enf>E(n+2)s。因此,在次外层电子数未达到最大容量时,已出现了最外层电子的填充,而最外层电子数未达到最大容量时,又进行次外层电子的填充;并且在更高的电子层出现之前,最外层中只可能出现s轨道和p轨道排有电子,因而最多容纳的电子数为8个;次外层中只能出现s轨道、p轨道和d轨道排有电子,其容纳的电子数不超过18个;余类推。例如,铅(Pb)原子最外层为6s26p2,共4个电子;次外层为5s25p65d10,共18个电子;外数第3层为4s24p64d104f14,共32个电子。如果某原子的6d轨道上占有电子,那末,它就不是最外层,按照能级高低的顺序,7s轨道将会排上2个电子。若第7层是最外层,则第6层就是次外层了。
利用电子层容量原理,可以根据元素的原子序数确定原子的电子层排布,写出原子结构示意图,推断元素在周期表里的位置。
二、饱和结构和稳定结构
饱和结构是指原子的每个电子层的电子数都达到2n2的电子层结构,能够达到饱和结构的原子是不多的,只有氦原子(2)、氖原子(2、8)。
稳定结构则是指符合电子层容量原理的电子层排布,即内电子层的电子数都达到2n2,而外电子层的电子数都达到2(m+1)2。稀有气体原子的电子层结构是这种稳定结构。
由上述叙述可知,原子的电子层结构中所谓的饱和结构和稳定结构是两个不同的概念,并且只能出现在稀有气体原子的电子层结构中,其它元素原子的电子层结构都不是稳定结构,更不可能是饱和结构,因为它们的电子层结构至少有一个外层电子数未达到2(m+1)2。但是这些原子有失去或得到电子形成稀有气体原子的电子层结构,这是是引起化学反应的根本原因。这种具有稀有气体原子电子层结构的离子,我们把它简称为稀型离子(稀型离子在元素周期的推断题中往往是很重要的条件和解题的关键)。因此,稀型离子的电子层结构是符合电子层容量原理的。我们一般把这种稳定结构叫做2电子结构和8电子结构,这是常见的一种稳定结构。除此以外,离子的电子层结构还有最外层为18电子的,不足18电子的,以及外电子层为(18+2)电子等的稳定结构。
三、能级交错的规律
对于核外电子排布的能级交错现象,我总结出以下规律。不同电子层上的能级发生交错的条件是:
亚层差=电子层差+1
即:ns<(n-1)d,ns<(n-2)f,np<(n-1)f,……
由此可以得出核外电子排布的能级高低顺序图:
1s<2s<2p<3s<3p<3d<4s<3d<4p<5s<4d<5p<6s<4f<5d<6p<7s
也可以从上关系中得出:从L层才会出现能级交错现象,即s和d的能级交错;而从P层才会出现s和f的能级交错;从O层才会出现p和f的能级交错。由到组成一个能级组,目前周期表中含有七个能级组,对应周期表里的七个周期。每一能级组中所所包含的电子数,就是对应周期的元素个数。如第6能级组为6s4f5d6p,共有32个电子,对应周期表里的第六周期的32个元素。
四、推断元素
已知元素的原子序数推断元素,确定其在元素周期表中的位置,一般有三种方法。
1.利用元素周期表的结构。用该元素的原子序数,从第一周期元素数目减起,直到减不够为止。如55号元素,55―2―8―8―18―18=1,故该元素为第六周期、第ⅠA族元素,为铯(Cs)。
此方法可以确定每一个元素,但必须熟悉元素周期表的结构,记住每一周期的元素个数。
2.利用电子排布式确定元素。如55号元素,其电子排布式为:1s22s22p63s23p63d104s24p64d105s25p66s1,得出该元素为第六周期、第ⅠA族元素,为铯(Cs)。
此方法可以确定每一个元素,但必须熟悉能级高低顺序,能正确地写出它的电子排布式。
3.利用原子结构示意图。周期序数=电子层数,主族序数=最外层电子数,由此确定元素在周期表里位置,并知道是什么元素。
利用电子层容量原理,根据元素的原子序数,可以确定稀有气体元素和Ⅳ—Ⅶ族元素原子的电子层排布,写出原子结构示意图。
例如,Rn原子核外有86个电子,有6个电子层。![]() =
=![]() =4。
=4。
当n<4时,每个电子层的电子数用2n2计算,这样,可得出K、L、M层的电子数依次为2,8,18。
当n≥4时,每个电子层的电子数用2(m+1)2计算:
N层,即外数第3层,m=3,电子数=2(3+1)2=32。
O层,即次外层,m=2,电子数=2(2+1)2=18。
P层,即最外层,m=1,电子数=2(1+1)2=8。
故Rn原子的电子层结构为:2,8,18,32,18,8。
又如,52号元素,原子核外有5个电子层。这是一个主族元素,最外层没有达到8个电子。
![]() =
=![]() =3.5。
=3.5。
即n<3.5的K、L、M层的电子数用2n2计算,分别为2,8,18。
n>3.5的N层为次外层,用2(m+1)2计算电子数,为18,余下的电子数就应排在最外层(O层),其电子数为52-(2+8+18+18)=6。
故该元素原子的电子层排布为:2,8,18,18,6。
如果只知道原子序数,不知道电子层数,则可按下述方法确定原子电子层排布。
稀有气体元素的电子层结构为:① 从内层往外数,每个电子层电子数为2n2;② 从外层往里数,每个电子层电子数为2(m+1)2;③ 以上两种关系,相交而止。
例如,54号元素Xe,有54个电子,按2n2确定K、L、M层的电子数,分别为2,8,18。(N层电子数为32,前4层的总电子数将大于54,不可能)前3层的总电子数为2+8+18=28,剩余电子数为54-28=26。
按照2(m+1)2,最外层8个电子,次外层18个电子,共26个电子,故Xe原子的电子层结构为2,8,18,18,8。
又如主族元素114号元素的原子,按2n2可排出:
K L M N
2 8 18 32
60
还剩114-60=54个电子。按2(m+1)2得出:
外数第3层 次外层 最外层
32 18 x
50
因此,最外层电子数应为x=54-50=4。该原子的电子层排布是2,8,18,32,32,18,4。

- 全部评论(0)
