新制氢氧化铜跟醛反应实验的探讨
时间:2021-04-23 11:08 来源:未知 作者:安勃 点击:次 所属专题: 乙醛与氢氧化铜 新制氢氧化铜
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
现行的全国通用高中及中师化学课本中,在醛一节里写道:乙醛也能被另一种弱氧化剂,即新制的氢氧化铜所氧化。又写道:由于乙醛具有还原性,所以能把反应中生成的氢氧化铜还原成红色的氧化亚铜沉淀。这也是检验醛基的一种方法。;
Cu2+十2OH-=Cu(OH)2↓
CH3CHO十2Cu(OH)2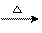 CH3COOH十Cu2O↓十2H2O
CH3COOH十Cu2O↓十2H2O
此处新制的氢氧化铜的涵义是什么呢?笔者认为应是氢氧化铜必须溶解在强碱(NaOH)溶液中。为说明这一问题,我们不妨先做下面的实验:
在一试管中加入少许氢氧化铜晶体粉末,再加入40%甲醛水溶液1mL,氢氧化铜为浅蓝色沉淀,放入沸水中加热,不发生反应.再滴加10%NaOH溶液,依次改变其pH值。发现当pH之9时,仍不发生反应。当pH=11-12时,一少部分Cu(OH):溶解转化为Cu(OH)42-,溶液变为浅蓝色(试管中仍有浅蓝色的Cu(OH)2沉淀)。当在沸水浴中加热时,Cu(OH)42-与甲醛反应生成了Cu2O红色沉淀(同时,试管底部的Cu(OH)2在较强的碱性条件下受热分解为CuO黑色沉淀)。当pH=14时,溶液的绎蓝色加深,说明有更多的Cu(OH)2转化为Cu(OH)42-。加热迅速产生物Cu2O红色沉淀。
上面的实验充分说明了强碱(NaOH)的存在对这一特效反应的重要性。据此,让我们再分析一下课本中的描述。
实验方法为:在一试管中,加入10%的NaOH溶液2mL,滴入2%CuSO4溶液4-8滴,振荡。然后加入乙醛水溶液0.5mL,加热至沸腾,观察溶液中有红色沉淀产生。
可见,该实验条件中所谓的“新制氢氧化铜”实际上是指氢氧化铜和氢氧化钠的混合液。因为,在远远过量的10%NaOH溶液中滴加4-8滴2%CuSO4溶液,混合溶液的pH>14,Cu2+有相当一部分是以Cu(OH)42-形式存在的。从实验的现象看,溶液呈锋蓝色,也说明了这一点(几乎看不到Cu(OH)2沉淀)。因此,我们认为,氢氧化钠直接参加了反应,所以将课本中的化学方程式改为下式更符合实际。
CH3CHO十2Cu(OH)2十NaOH CH3COONa十Cu2O十3H2O
CH3COONa十Cu2O十3H2O
原教材强调使用“新制的氢氧化铜”,是因为从溶液中新沉淀生成的氢氧化铜比较容易溶于NaOH溶液,生成Cu(OH)42-离子。该离子和醛类溶液的反应才是均相反应,反应速度较快。否则,固体Cu(OH)2颗粒和醛类反应,即使有Cu2O生成,它沉积覆盖包裹在Cu(OH)2颗粒上,隔离了两种反应物,使反应不能继续进行。

- 全部评论(0)
(3047531663) 评论 新制氢氧化铜跟醛反应实验:这种探究实验很棒
