π键的形成
时间:2023-05-10 14:49 来源:未知 作者:张劲辉 点击:次 所属专题: 共价键 π键
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
原子轨道按“肩并肩”的方式发生轨道重叠,轨道重叠部分对通过键轴的一个平面具有镜面反对称,这种共价键称为π键。除p-p轨道可以重叠形成π键外,p-d,d-d轨道重叠也可以形成π键。
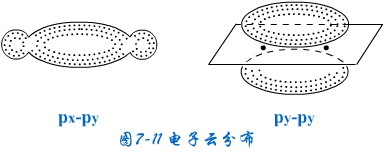
由于σ键对键轴呈圆柱形对称,所以电子云在两核之间密集,π键对键轴平面呈镜面反对称,电子云在键轴上下密集(见图7-11)。σ键是两个成键原子轨道沿值最大的方向重叠而成,满足轨道最大重叠原理,两核间浓密的电子云将两个成键原子核强烈地吸引在一起,所以σ键的键能大,稳定性高。形成 π键时轨道不可能满足最大重叠原理,只采用“肩并肩”的方式重叠,使得在键轴平面上的电子云密度为零,只有通过键轴平面上、下两块电子云将两核吸在一起,这二块π键电子云离核较远,一般情况是π键的稳定性小,π电子活泼,容易参与化学反应。
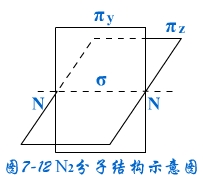
两个原子可以形成多重键,其中必定先形成一个σ键,其余为π键。例如N2分子有三个键,一个σ键,两个π键,.示意如图7-12。
σ键由2px-2px轨道形成;π键分别2py-2py;2pz-2pz由轨道形成。p轨道的方向决定了N2分子中三个键互相垂直。
(责任编辑:)

说点什么吧
- 全部评论(0)
还没有评论,快来抢沙发吧!
