决定共价键极性强弱的因素
时间:2012-12-03 10:57 来源:未知 作者:陈爱玉 点击:次 所属专题: 键的极性
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
在共价化合物中形成弱极性键或强极性键是由哪些因素来决定的?电负性差值达到什么程度,极性键就转变为离子键?
在共价化合物中,由于不同元素的原子吸引电子的能力不同,共用电子对就必然或多或少地偏向于对它吸引力较大的那个原子(即电子云密度大的地方将偏近于这个原子),所以形成的键就具有不同程度的极性。两种元素的电负性相差越大,它们之间键的极性就越强,其中,电负性较大的原子为负极,电负性较小的原子为正极。例如,卤素中氟的电负性为4.0,氯为3.0,溴为2.8,碘为2.5,而氢的电负性为2.1。显然,在卤化氢分子中键的极性强弱的程度应为:
HF>HCl>HBr>HI
其中H—F和H—Cl为强极性键,H—I为弱极性键,而H—Br则介于两者之间。卤素原子是负极,氢原子是正极。又如CH4中的C—H键,由于碳的电负性为2.5,与氢的相差很小,所以是弱极性键,碳是负极,氢是正极。
电负性差值与键的极性之间有没有严格的定量关系?电负性差值达到什么程度,极性键就转变为离子键?对于诸如此类的问题,很难做出肯定的回答,因为在离子键和共价键之间没有一条绝对分明和固定不变的界限。
近代实验表明,即使在由电负性最小的铯和电负性最大的氟形成的最典型的离子型化合物氟化铯中,键的离子性也不是百分之百,而只有92%。我们可以用离子性百分数来表示键的离子性相对于共价性的大小。对于AB型化合物单键离子性百分数和电负性差值(XA—XB)之间的关系如表所示。
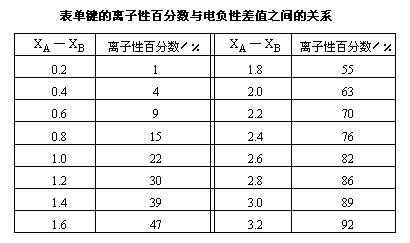
从表可知,当两个原子电负性差值约为1.7时,单键约具有50%的离子性,这是一个重要的参考数据。如果两个原子电负性差值大于1.7时,可判断它们之间主要形成离子键,该物质是离子型化合物;如果两个原子电负性差值小于1.7,则可判断它们之间主要形成共价键,该物质为共价化合物。例如钠的电负性为0.9,氯的电负性为3.0,两原子的电负性差值为2.1,当它们互相结合成NaCl时,其键的离子性百分数约为70%。因此可以判断氯化钠中钠离子与氯离子之间主要是形成离子键,氯化钠为离子型化合物。

- 全部评论(0)
