为什么铁先失去4s的电子,而不是3d的电子?
时间:2023-05-04 10:00 来源:未知 作者:程波 点击:次 所属专题: 铁的失电子
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
鲍林的能级图只是个近似的能级图,是帮助我们理解电子的填充过程。
但电子填充后轨道能级会发生改变,电子的失去过程必须用科顿原子轨道能级图来解释。
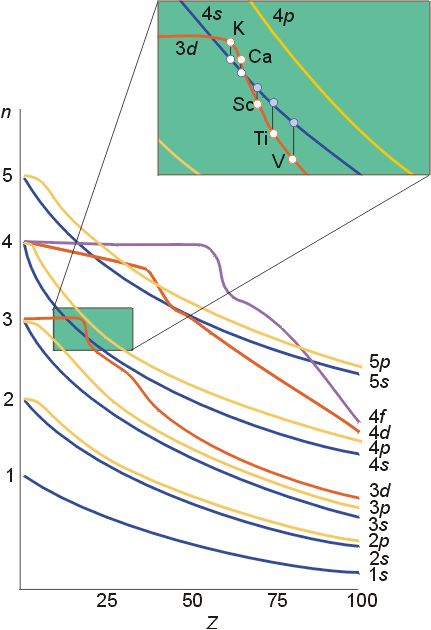
Pauling近似能级图是在没有考虑外层电子对内层电子影响下提出的,而Cotton原子轨道能级图考虑了外层电子对内层电子的挤压效应。举个简单的例子,一座大楼,随着大楼变高,一楼承受的压力越大,这样就会使一楼逐渐被“压扁”(当然,这个效应很弱,否则谁还敢住一楼),原子也是这样,随着核电荷数的升高内层电子就会逐渐趋于稳定,这使得内层电子能量逐渐降低。Cotton原子轨道能级图正是反映了这种效应,只不过由于3d和4s在核电荷数升高时能量降低幅度不一样,造成了这种暂时性的能级交错。事实上,这种效应(3d>4s)只维持到了25号元素,后面的元素都是4s>3d的,事实上,随着原子序数的增加,4s和3d都趋于稳定,只不过3d能量降得比较快(受挤压效应影响大)而已。
其实电子排布不但有能量最低原理,还有泡里不相容原理,洪特规则等等,是一个相互影响相互协调的过程。
所谓的能级交错,是指电子层数较大的某些轨道的能量反低于电子层数较小的某些轨道能量的现象。由于屏蔽效应和钻穿效应,使不同轨道上的电子能级发生变化,从而引起能级上的交错。 如4s反而比3d的能量小,填充电子时应先充满4s而后才填入3d轨道。过渡元素钪的外层电子排布为4s23d1,失去电子时,按能级交错应先失去3d电子,成为4s23d0,而从原子光谱实验得知,却是先失4s上的电子成为4s13d1。这是由于3d电子的存在,削弱了原子核对4s电子的吸引而易失去的。过渡元素离子化时,大体是先失去ns电子,但也有先失去(n-1)d电子的,像钇等。能级交错的顺序不是绝对不变的,在原子序数大的原子中,3d轨道可能比4s轨道的能量低。
【小结】:填充时考虑能级交错,失电子时考虑先外后内。在3d、4s都没有电子的时候,能量是3d高于4s,当形成原子以后,填充了电子,力场发生变化,不再能级交错,就是4s高于3d。

- 全部评论(0)
(728633958) 评论 为什么铁先失去4s的电子,:决不打赏,嘿嘿。
