浅议等电子原理
时间:2022-11-21 08:48 来源:未知 作者:邱东兰 点击:次 所属专题: 等电子体
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
等电子原理是现行普通高中课程标准 实验教科书化学选修3《物质结构与性质》 第二章《分子结构与性质》的第一节《共价键》中的一个重要的知识内容。
其概念是这样定义的原子总数相同且 价电子总数也相同的分子或离子具有相同 的结构特征,这个原理就称为“等电子原 理”。这里的“结构特征”的概念既包括其 立体结构,又包括化学键的类型,但键角不一定相等,除非键角为180°、120°及 109°28'等特定的角度。
等电子体之间的许多性质是相似、相近 甚至是相同的。
课本上表2- 3列举了 CO和N2的某些 性质。
分子 | 熔点 | 沸点 | 在水中的溶解 | 分子解 离能 | 分子的价电子 |
| CO | 205.05 | 191.49 | 2.3mL | 1075 | 10 |
N2 | 210 | 195 | 1.6mL | 946 | 10 |
上述数据表明,CO和N2在许多性质 上十分相似,这些相似性可以归纳为它们具 有相等的原子数和价电子总数,导致它们具 有相似的化学结构和性质,它们之间互称为等电子体。其实,它们和C22- 、CN-及O22+等这些离子也互称为等电子体。这样的例子很多,例如:
(一) CO2、CS2、N2O、BeCl2、 OCN-、SCN-、NO2+、CN22-及 N3-等,价电子数之和皆为16,具有相同的结构——直线型结构,中心原子上没有孤对电 子而取sp杂化轨道,形成直线型σ骨架,键角为180。
(二)BF3、BBr3、SO3、 NO3-、CO32-等具有相同的通式AX3,总价电子数为24,有相同的结构一平面三角形构型,中心原子上没有孤对电子而取sp2杂化轨道形成微粒的σ骨架,键角为 120
(三)CF4、CCl4、SiCl4、 SiF4、 SiO44-、PO43-、SO42- 、ClO4-等具有的AX4通式,总价电子数为32,中心原子有4个σ键,故取sp3杂化形式,微粒呈正四面体的立体结构,键角为 109°28'。
除此之外,还有:
(四)sp2杂化30个价电子的苯和无机苯(B3N3H6)都是平面结构。
(五)sp2杂化18个价电子的SO2、O3和NO2-等都是角形构型。
(六)sp3杂化8个价电子的CH4、 NH4+和BH4-都是正四面体构型。
(七)sp3杂化8个价电子的NH3、H3O+和CH3+等都是三角锥形。
(八)sp3杂化26个价电子的ClO3-、SO32-和PO32-等都是三角锥构形。
等等,这些都是等电子原理的具体应用的结果。
我们只要理解了等电子原理的概念,就 能熟练地判断物质或微粒之间属于不属于等电子体,进而就会帮助我们解决好多实际问题。根据已知物质或微粒的结构与性质来 推测和判断未知物质或微粒的化学键特征 和许多性质——有无孤对电子、杂化类型、 VSEPR模型、立体构型及结构式或电子式 的书写等。
例如:据CO2的知识内容可得出笑气N2O和NaN3里的N3-中三个原子都处于一条直线上且都含有两个π键。
再如:据中存在氮氮叁键可写出C2-、CN-、O22+和NO+的电子式依次为:
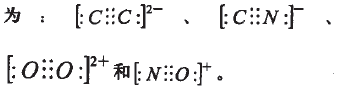

- 全部评论(0)
