为什么胶粒带电,胶体不带电?
时间:2020-10-26 16:49 来源:未知 作者:化学自习室 点击: 次 所属专题: 胶粒
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
胶体的结构应该称作是双电层结构。
要认识胶体的结构,首先必须了解胶粒为什么会带电。胶粒带电的原因,是由于胶体是高分散的多相体系,具有巨大的界面(总表面积),因而有很强的吸附能力。它能有选择地吸附介质中的某种离子,而形成带电的胶粒。
关于胶体的结构,现在认为,在胶体粒子的中心,是一个由许多分子聚集而成的固体颗粒,叫做胶核。在胶核的表面常常吸附一层组成类似的、带相同电荷的离子。例如,硝酸银与氯化钾反应,生成氯化银溶胶,若氯化钾过量,则胶核氯化银吸附过量的Cl-而带负电,若硝酸银过量,则氯化银吸附过量的Ag+而带正电。
当胶核表面吸附了离子而带电后,在它周围的液体中,与胶核表面电性相反的离子会扩散到胶核附近,并与胶核表面电荷形成扩散双电层(图1)。扩散双电层由两部分构成:
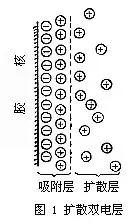
(1)吸附层
胶核表面吸附着的离子,由于静电引力,又吸引了一部分带相反电荷的离子(以下简称反离子),形成吸附层。
(2)扩散层
除吸附层中的反离子外,其余的反离子扩散分布在吸附层的外围。距离吸附层的界面越远,反离子浓度越小,到了胶核表面电荷影响不到之处,反离子浓度就等于零。从吸附层界面(图的虚线)到反离子浓度为零的区域叫做扩散层。
这里再以氯化银溶胶为例来说明。包围着氯化银胶核的是扩散双电层(吸附层和扩散层),胶核和吸附层构成了胶粒,胶粒和扩散层形成的整体为胶团,在胶团中吸附离子的电荷数与反离子的电荷数相等,因此胶粒是带电的,而整个胶团是电中性的。
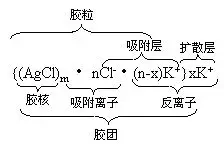
由于胶核对吸附层的吸引能力较强,对扩散层的吸引能力弱,因此在外加电场(如通直流电)作用下,胶团会从吸附层与扩散层之间分裂,形成带电荷的胶粒而发生电泳现象。
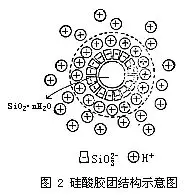
图2是硅酸胶团结构示意图。m个SiO2··nH2O分子聚集成胶核,胶核表面的H2SiO3有微弱的电离,胶核选择吸附与其组成类似的n个
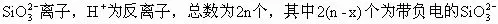
所吸引,共同构成胶粒中的吸附层,其余的2x个H+则分布在扩散层中,它的胶团结构也可以用下面式子来表示。
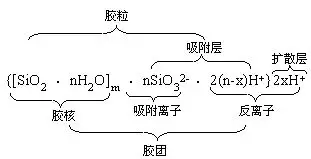
硅酸溶胶是土壤胶体中的重要部分,而土壤胶体又是土壤中最重要、最活跃的部分,植物营养的吸收,土壤中的各种反应,大都集中在这一部分。
胶体在土壤肥力上起着巨大作用,在工农业生产上有着重要意义。

- 全部评论(0)
