考前辅导:回归课本超级判断题
时间:2023-05-15 11:03 来源:未知 作者:化学自习室 点击:次 所属专题: 回归课本
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
(1)将MgCl2溶液加热蒸干可制备无水MgCl2。
(2)用热碱水清除炊具上残留的油污发生了化学反应。
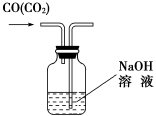
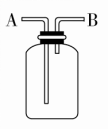
(3)用图1除去CO气体中的CO2气体。
 |  |  |  |
| 图1 | 图2 | 图3 | 图4 |
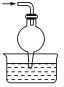
(4)用图2进行NaHCO3受热分解。
(5)烧瓶、烧杯、锥形瓶、试管、量筒加热时均需垫石棉网。
(6)稀盐酸和稀HNO3可分别除去烧瓶内残留的MnO2和试管内壁的银镜。
(7)用玻璃棒蘸取CH3COOH溶液点在用水湿润的pH试纸上,测定该溶液的pH。
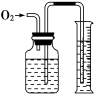
(8)用图3装置可防止倒吸。
(9)用H2还原CuO的实验结束时先停止通H2再停止加热。
(10)用图4可量取O2的体积。
(11)除去Cu粉中混有的CuO的操作是加入稀HNO3溶解、过滤、洗涤、干燥。
(12)提取海水中的Mg2+,工业生产中常选用NaOH作为沉淀剂。
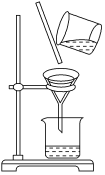
(13)用如图除去粗盐溶液中的不溶物。
(14)分离溶于水的碘可用乙醇萃取,其原理为碘在乙醇中的溶解度较大。
(15)某溶液加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+。
(16)能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2。
(17)蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热。
(18)蒸馏操作时,应使温度计的水银球插入蒸馏烧瓶溶液中。
(19)分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出。
(20)只滴加氨水鉴别NaCl、AlCl3、MgCl2、Na2SO4四种溶液。
(21)能使品红褪色的气体一定是SO2。
(22)使湿润的淀粉-KI试纸变蓝的气体一定是Cl2。
(23)某溶液做焰色反应时呈黄色,该溶液中一定只含Na+,不含K+。
(24)SO2中混有少量NH3,可以将混合气体通过浓硫酸除去。
(25)除去SO2中的少量HCl,可将混合气体通过饱和Na2SO3溶液。
(26)FeCl2溶液中混有FeCl3可加入铜粉除去。
(27)某溶液中加入HNO3酸化的BaCl2溶液产生白色沉淀,则溶液中一定含SO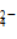 。
。
(28)加入浓NaOH溶液加热产生能使湿润的红色石蕊试纸变蓝的气体,说明该溶液中一定含有NH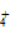 。
。
(29)用Na2CO3溶液不能区分CH3COOH和CH3COOCH2CH3。
(30)提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再冷却结晶、过滤、干燥的方法。
(31)用大理石与稀硫酸反应可快速制取CO2。
(32)将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置,下层溶液显紫红色,证明氧化性:Fe3+>I2。
(33)分别加热Na2CO3和NaHCO3固体,试管内壁都有水珠,说明两种物质均受热分解。
(34)可以用加热分解NH4Cl、NH4HCO3等铵盐快速制NH3。
(35)启普发生器可用于制备H2、CO2、O2、C2H4等气体。
(36)气体由A通入时,可用于收集NO、NO2气体,气体由b通入时,可用于收集H2、NH3、CH4等气体。
(37)加热盛有NH4Cl固体的试管,试管底部固体消失,试管口有晶体凝结,则NH4Cl固体可以升华。
(38)容量瓶、分液漏斗、酸(碱)式滴定管使用前都要先检漏、洗涤,酸(碱)式滴定管还需用待盛液体润洗。
(39)使食盐水中NaCl晶体析出时,常用到的仪器有坩埚、酒精灯、玻璃棒、泥三角。
(40)用分液漏斗分离苯与四氯化碳的混合物,可将四氯化碳从下口放出,苯从上口倒出。
(41)比较水与乙醇中氢的活泼性,可分别将少量钠投入到盛有水和乙醇的烧杯中,观察现象。
(42)由乙烯生成乙醇属于加成反应,油脂和蛋白质都属于高分子化合物。
(43)乙醇室温下在水中的溶解度大于溴乙烷。
(44)乙酸与甲酸甲酯互为同分异构体。
(45)分离乙酸乙酯和乙醇采用分液的原理是乙酸乙酯和乙醇的密度不同。
(46)除去丁醇中的乙醚采用蒸馏法的原理是丁醇与乙醚的沸点相差较大。
(47)淀粉、纤维素和油脂都属于天然高分子化合物。
(48)淀粉和纤维素分子式都是(C6H10O5)n,互为同分异构体。
(49)糖类、油脂、蛋白质完全燃烧产物都是CO2和H2O。
(50)糖类、油脂、蛋白质均能发生水解反应。
(51)以液化石油气代替燃油可减少大气污染。
(52)2-甲基丁烷也称为异丁烷,C4H9Cl有3种同分异构体。
(53)乙烷室温下能与浓盐酸发生取代反应,乙烯可以用作生产食品包装材料的原料。
(54)60 g 丙醇中存在的共价键总数为10NA。
(55)用浸泡过高锰酸钾溶液的硅藻土保鲜水果的过程没有发生化学反应。
(56)合成纤维和光导纤维都是新型无机非金属材料。
(57)聚合物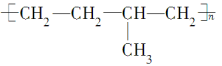 可由单体CH3CH===CH2和CH2===CH2加聚制得。
可由单体CH3CH===CH2和CH2===CH2加聚制得。
(58)C5H10O2的羧酸共有4种。
(59)CH3—CH2—CH===CH2能使溴水、酸性KMnO4溶液退色,二者退色原理相同。
(60)煤的干馏和石油的分馏均为化学变化。
(61)CH3CH2OH与CH2OHCH2OH是同系物。
(62)官能团相同的物质一定是同一类物质。
(63) 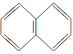 属于苯的同系物、芳香烃和芳香族化合物。
属于苯的同系物、芳香烃和芳香族化合物。
(64) 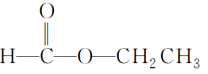 含有醛基,属于醛类。
含有醛基,属于醛类。
(65) 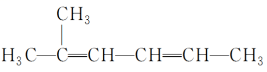 2-甲基-2,4-己二烯。
2-甲基-2,4-己二烯。
(66)相同碳原子数的饱和一元醛和饱和一元酮互为同分异构体。
(67)根据物质的沸点利用蒸馏法提纯液态有机物时,沸点相差大于30 ℃为宜。
(68)对有机物分子红外光谱图的研究有助于确定有机物分子中的官能团。
(69)有机物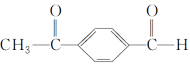 核磁共振氢谱中会出现三组峰,且峰面积之比为3∶4∶1。
核磁共振氢谱中会出现三组峰,且峰面积之比为3∶4∶1。
(70)高温消毒与酒精消毒均与细菌蛋白质的变性有关。
(71)氟利昂(卤代烃)可用作制冷剂,释放到空气中容易导致臭氧层空洞。
(72)CH3CH2Cl的沸点比CH3CH3的沸点高。
(73)所有的卤代烃都能发生水解反应和消去反应。
(74)用AgNO3溶液和稀硝酸便可检验卤代烃中的氯、溴、碘元素。
(75)溴乙烷与NaOH的醇溶液反应,可生成乙醇。
(76)C2H5Br属于电解质,在碱的水溶液中加热可生成C2H5OH。
(77)溴水和酸性KMnO4溶液既可除去乙烷中的乙烯,也可以鉴别乙烷与乙烯。
(78)将石蜡油在碎瓷片上受热分解产生的气体能使溴的CCl4溶液褪色。
(79)烷烃同分异构体之间,支链越多,沸点越高。
(80)CHFClH和CHHClF是两种不同的物质,它们互为同分异构体。
(81)1 mol HHO与足量银氨溶液在加热的条件下充分反应,可生成2 mol Ag。
(82)完全燃烧等质量的乙醛和乙酸乙酯,消耗O2的质量相等。
(83)醛基、羧基和酯基中的碳氧双键均能与H2加成。
(84)在水溶液里CH3COOH中的-CH3可以电离出H+,故CH3COOH是四元酸。
(85)甲酸能发生银镜反应,能与新制Cu(OH)2在碱性悬浊液中反应生成红色沉淀。
(86)乙酸乙酯中的少量乙酸可用饱和NaOH溶液除去。
(87)用新制的银氨溶液可以区分甲酸甲酯与乙醛。
(88)苯与溴水充分振荡后,溴水褪色说明苯分子中的碳原子没有饱和。
(89)棉花、蚕丝、羊毛、天然橡胶都属于天然高分子化合物。
(90)天然橡胶是高聚物,不能使溴水褪色。
1-10 | ×√×××××√×√ | 11-20 | ××××××××√× |
21-30 | ×××√×××√×× | 31-40 | ×√×××××√×× |
41-50 | √×√√×√×××× | 51-60 | √×××××√√×× |
61-70 | ××××√√√√×√ | 71-80 | √√×××××√×× |
81-90 | ×√××√×××√× |
(1)利用粮食酿酒经历了淀粉→葡萄糖→乙醇的化学变化过程。
(2)凡分子组成符合Cn(H2O)m的化合物都属于糖类。
(3)油脂是高级脂肪酸的甘油酯,为天然高分子化合物。
(4)油脂都不能使溴水和酸性高锰酸钾溶液褪色。
(5)向淀粉水解后所得水解液中滴加碘水,溶液未变蓝色,说明淀粉没有发生水解。
(6)将(NH4)2SO4、CuSO4溶液分别加入蛋白质溶液,都出现沉淀,表明二者均可使蛋白质变性。
(7)通过盐析可提纯蛋白质,并保护其生理活性。
(8)蚕丝织物上沾有的血迹可以用加酶洗衣粉洗涤除去。
(9) 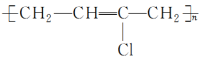 的单体是CH2=CH2和
的单体是CH2=CH2和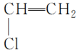 。
。
(10)通过加成反应不能引入碳碳双键官能团。
(11)乙烯和苯都能使溴水褪色,褪色的原理相同。
(12)SO2使溴水褪色与乙烯使KMnO4溶液褪色的原理相同。
(13)乙烯、聚乙烯和苯分子中均含有碳碳双键,都能发生加成反应。
(14)甲烷的二氯取代产物只有1种,说明甲烷是正四面体结构而不是平面结构。
(15)煤中含有苯、甲苯、二甲苯等有机化合物。
(16)石油是混合物,经分馏后得到汽油、煤油和柴油等纯净物。
(17)裂化的目的是得到轻质油,裂解的目的是得到乙烯、丙烯等化工原料。
(18) 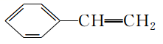 分子中所有原子可能在同一平面上。
分子中所有原子可能在同一平面上。
(19)酯基官能团只能通过酯化反应得到。
(20)有机合成的思路就是通过有机反应构建目标化合物的分子碳架,并引入或转化成所需的官能团。
(21)0·1mol 乙醇与足量的钠反应生成0.05 mol H2,说明乙醇分子中有一个羟基。
(22)将铜片在酒精灯火焰上加热后插入到无水乙醇中,放置片刻,铜片质量最终不变。
(23)乙醇能与金属钠反应,说明在反应中乙醇分子断裂C—O 键而失去羟基。
(24)在制备乙酸乙酯后剩余的反应液中加入碳酸钠溶液,产生气泡,说明还有乙酸剩余。
(25)将乙醇和浓硫酸共热后得到的气体通入溴水中,溴水褪色,说明生成了乙烯。
(26)在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH。
(27)棉、麻、羊毛及合成纤维完全燃烧都只生成CO2和H2O。
(28)用加酶洗衣粉洗涤毛织品效果更好。
(29)蛋白质、纤维素、蔗糖都是高分子化合物。
(30)C6H13Cl的同分异构体有m(种),则C6H14O的醇也有m(种)。
(31)CH3OH和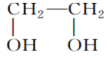 都属于醇类,且二者互为同分异构体。
都属于醇类,且二者互为同分异构体。
(32)CH3CH2OH在水中的溶解度大于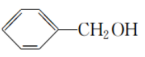 在水中的溶解度。
在水中的溶解度。
(33)CH3OH、CH3CH2OH、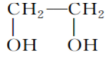 的沸点逐渐升高。
的沸点逐渐升高。
(34)往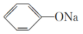 溶液中通入少量的CO2的离子方程式为
溶液中通入少量的CO2的离子方程式为
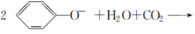
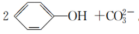 。
。
(35)乙醇的分子间脱水反应和酯化反应都属于取代反应。
(36)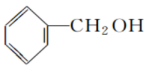 和
和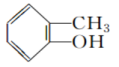 含有的官能团相同,二者的化学性质相似。
含有的官能团相同,二者的化学性质相似。
(37)实验时手指上不小心沾上苯酚,立即用70 ℃以上的热水清洗。
(38)鉴别苯酚溶液与乙醇溶液可滴加FeCl3溶液。
(39)逆合成分析法可以简单表示为目标化合物→中间体Ⅱ→中间体Ⅰ→基础原料。
(40)为减少污染,有机合成不能使用辅助原料,不能有副产物。
(41)向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中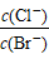 不变。
不变。
(42)粗盐可采用除杂和重结晶等过程提纯。
(43)将Na2S与稀H2SO4反应生成的气体通入AgNO3与AgCl的溶液中,根据现象可得出Ksp(AgCl)>Ksp(Ag2S)。
(44)向FeCl3溶液中加入Mg(OH)2反应的方程式为3Mg(OH)2+2Fe3+===2Fe(OH)3+3Mg2+。
(45)0·1 mol AgCl和0.1 mol AgI混合后加入1 L 水中,所得溶液中c(Cl-)=c(I-)。
(46)已知Ksp(AgCl)>Ksp(Ag2CrO4)故溶解度S(AgCl)>S(Ag2CrO4)。
(47)常温下,向BaCO3饱和溶液中加入Na2CO3固体,Ksp(BaCO3)减小。
(48)AgCl(s)+I-⇌AgI(s)+Cl-的化学平衡常数K= 。
。
(49)室温下,AgCl在水中的溶解度小于在食盐水中的溶解度。
(50)向NaOH溶液中加入几滴MgCl2溶液,溶液中有白色沉淀,然后再加入FeCl3溶液,又生成红褐色沉淀,可证明Ksp[Fe(OH)3]<Ksp[Mg(OH)2]。
(51)将CH3COONa溶液从20 ℃升温至30 ℃,溶液中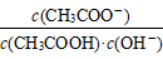 增大。
增大。
(52)室温下,测得氯化铵溶液pH<7,证明一水合氨是弱碱:NH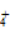 +2H2O===NH3·H2O+H3O+。
+2H2O===NH3·H2O+H3O+。
(53)氯化铝在水中形成具有净水作用的氢氧化铝胶体,其反应的离子方程式为Al3++3H2O⇌Al(OH)3(胶体)+3H+。
(54)25 ℃时,等体积等浓度的硝酸与氨水混合后,溶液pH=7。
(55)施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用的原因是K2CO3与NH4Cl反应生成NH3会降低肥效。
(56)向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成。
(57)由0.1 mol·L-1HA溶液的pH=3,可推知NaA溶液中存在A-+H2O⇌HA+OH-。
(58)pH=5的NH4Cl溶液中水电离出的c(H+)=10-9mol/L。
(59)将MgCl2溶液蒸干灼烧制备MgCl2固体。
(60)向FeCl3溶液中通入适量HCl气体,溶液中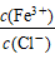 增大。
增大。
(61)向盐酸中加入氨水至中性,溶液中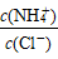 >1。
>1。
(62)pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5mol·L-1。
(63)pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1。
(64)25 ℃时pH=13的NaOH溶液中含有OH-的数目为0.1NA。
(65)向水中加入酸式盐,溶液呈酸性,是因为促进了水的电离。
(66)用湿润的pH试纸测定酸溶液的pH结果偏大。
(67)用碱式滴定管盛放酸性KMnO4溶液、溴水、CCl4等试剂。
(68)用醋酸溶液滴定待测NaOH溶液的浓度可用酚酞作指示剂。
(69)中和滴定前仰视读数滴定后俯视读数,结果偏小。
(70)25 ℃时,用CH3COOH滴定等浓度的NaOH溶液至pH=7,V(CH3COOH)<V(NaOH)。
(71)盐酸中滴加氨水至中性,溶液中溶质为NH4Cl。
(72)向0.1 mol·L-1CH3COOH溶液中加入少量水,溶液中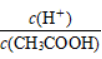 减小
减小
(73)2 L 0.5 mol·L-1亚硫酸溶液中含有的H+离子数为2NA。
(74)醋酸溶液中加冰醋酸,醋酸的电离平衡右移,增大了醋酸电离程度。
(75)25 ℃时,0.1 mol·L-1的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱。
(76)为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A为强酸。
(77)25 ℃时,pH之和等于14的酸碱等体积混合,混合液的pH=7。
(78)25 ℃时,同浓度的盐酸与氨水等体积混合,混合液的pH<7。
(79)常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4。
(80)0·1 mol/L 的氨水加H2O稀释,所得溶液中的c(H+)增大。
(81)等体积等pH的盐酸与醋酸分别和足量Zn反应,生成H2的物质的量相同。
(82)25 ℃ pH=4的0.1 mol/L 的HA溶液中,Ha的电离常数约为10-7。
(83)利用气体的总压、平均相对分子质量和密度不变均可作为反应到达平衡标志。
(84)当同一物质的v(正)=v(逆)时,反应一定达到平衡状态。
(85)在一固定容积的容器中发生C(s)+H2O(g)⇌CO(g)+H2(g)反应,当气体密度不变时,说明反应已达平衡。
(86)往平衡体系FeCl3+3KSCN⇌Fe(SCN)3+3KCl中加入KCl固体,平衡将向逆反应方向移动,溶液颜色将变浅。
(87)对于2NO2(g)⇌N2O4(g)平衡体系,扩大体积减小压强,再达到平衡时颜色变深。
(88)对于密闭容器中的可逆反应mX(g)+nY(s)⇌pZ(g) ΔH<0,达化学平衡后,通入氦气,化学平衡一定发生移动。
(89)升高温度,平衡向吸热反应方向移动,此时v(吸)增大,v(放)减小。
(90)通过改变一个条件使某反应向正反应方向移动,转化率一定增大。
(91)若平衡发生移动,则v(正)和v(逆)一定改变,同理v(正)、v(逆)改变,平衡一定移动。
(92)对于2NH3⇌N2+3H2反应,恒温恒容下再充入一定量的NH3,NH3的转化率增大。
(93)对于任何可逆反应,改变体系的温度,平衡一定发生移动。
(94)化学平衡常数表达式中的浓度可以用物质的量代替计算。
(95)增大压强,化学平衡向右移动,反应物的转化率增大,平衡常数也增大。
(96)升高温度,反应的平衡常数一定增大。
(97)化学平衡常数增大,化学平衡一定向正反应方向移动。
(98)ΔH<0,ΔS>0的反应一定自发进行。
(99)平衡常数和转化率都能体现可逆反应进行的程度。
(100)C(s)+H2O(g)⇌CO(g)+H2(g)的K表达式为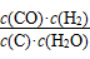 。
。
(101)一个可逆反应的正反应K正与逆反应K逆相等。
(102)一定温度下,N2(g)+3H2(g)⇌2NH3(g)的K1与2N2(g)+6H2(g)⇌4NH3(g)的K2的关系为K1=2K2。
(103)从热力学的角度,2NO(g)+2CO(g)===N2(g)+2CO2(g) ΔH>0的反应不可能自发进行。
(104)在一定温度下的恒容密闭容器中发生N2(g)+3H2(g)⇌2NH3(g)反应,当密度不变时,反应达到平衡状态。
(105)对于2SO2(g) +O2(g)⇌2SO3(g)反应,当v(正)(SO2)=v(逆)(O2)时,反应达到平衡。
1-10 | √×××××√××× | 11-20 | ×√×√××√√×√ |
21-30 | √√×××××××√ | 31-40 | ×√√×√××√√× |
41-50 | √√×√×××√×× | 51-60 | ××√×√×√××× |
61-71 | ×××××√×√√×× | 72-82 | ×××√××√×√×√ |
83-93 | ×√√×××××××√ | 94-105 | ×××√√√×××√×× |

- 全部评论(0)
