教材分析(必修一):氯及其化合物
时间:2023-08-08 15:04 来源:未知 作者:张德金 点击:次 所属专题: 氯及其化合物
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、氯气
1、氯气的发现和确认
【教材阅读】(1)舍勒:瑞典化学家,用软锰矿(主要是MnO2)与浓盐酸混合加热产生了氯气。
(2)戴维:英国化学家,确认了氯气。
2、氯气的物理性质
【实验】观察颜色状态:黄绿色气体,有刺激性气味。
【教材阅读】毒性:有毒。水溶性:常温下与水体积比1:2溶于水。
【推理】密度:比空气密度大。
工业储存:先液化,再储存在钢瓶中。
3、氯原子的结构
最外层7个电子。
【推理】易得电子,有强氧化性。“易”“强”与只需得1个电子有关。
4、氯气的化学性质:(与强氧化性有关)
(1)与金属反应:与大多数金属能化合。
①钠:【演示实验】黄色火焰,白烟,剧烈反应。2Na+Cl2 2NaCl
2NaCl
②铁:【演示实验】棕褐色烟,加水溶解后得棕黄色FeCl3溶液。2Fe+3Cl2 2FeCl3(得到高价铁,说明Cl2氧化性强)
2FeCl3(得到高价铁,说明Cl2氧化性强)
③铜:【演示实验】棕黄色烟,加水溶解后得蓝绿色CuCl2溶液。Cu+Cl2 FeCl2
FeCl2
(2)与非金属反应:与大多数非金属单质能化合。
①H2:【演示实验】H2在Cl2中继续燃烧,火焰苍白色,瓶口出现白雾。H2+Cl2 2HCl
2HCl
②【教材阅读】出现白雾的原因是生成的HCl在空气中与水蒸气结合,形成盐酸小液滴。
③燃烧不一定需要氧气。
(3)与水的反应:
①【教材阅读】溶于水的氯气只有一部分与水发生反应:
Cl2+H2O=HCl+HClO
②氯水:氯气溶于水得到的溶液,主要成分有H2O、Cl2、HCl、HClO。
【分析】从离子的角度分析有“三分子四离子”:H2O、Cl2、HClO,H+、Cl-、ClO-、OH-。(需要介绍强电解质、弱电解质概念)
(4)与碱的反应:
①承接Cl2与水的反应。
NaOH溶液:【推理】Cl2+2NaOH=NaCl+NaClO+H2O
Ca(OH)2溶液:【推理】2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
②什么是漂白液?Cl2通入NaOH溶液中得到,也就是NaClO和NaCl的混合液。
84消毒液的主要成分是NaClO。
③什么是漂白粉?Cl2通入冷的石灰乳中得到,也就是Ca(ClO)2和CaCl2的混合固体。
④什么是漂粉精?Cl2与Ca(OH)2充分反应,得到以Ca(ClO)2为主的固体。
漂白液、漂白粉溶液、漂粉精溶液中都含有HClO。
⑤氯水与碱反应的意义:
将不稳定的氯水转化为较稳定的次氯酸盐,更容易保存,使用也方便,漂白效果也更明显。
(5)与酸、盐的反应:
与还原性的酸、盐反应
复习氧化还原反应中学过的化合物还原剂
①与亚硫酸:SO2+2H2O+Cl2=H2SO4+2HCl
②与Na2S溶液:Na2S+Cl2=S↓+2NaCl
③与Na2SO3溶液:Na2SO3+H2O+Cl2= Na2SO4+2HCl
④与KI溶液:2KI+Cl2=I2+2KCl
⑤与FeCl2溶液:2FeCl2+Cl2=FeCl3
5、氯气的用途:
可以制盐酸、有机溶剂、农药、染料、药品等。
制有机溶剂四氯化碳:CH4+4Cl2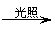 CCl4+4HCl
CCl4+4HCl
制农药666:C6H6(苯)+3Cl2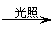 C6H6Cl6
C6H6Cl6
二、次氯酸的性质
HClO从结构上看,是一元酸,有酸性。Cl显+1价,很不稳定,显示为强氧化性。
1、有漂白性。
【实验】干燥的布条,湿润的布条分别放入盛有干燥的氯气的集气瓶中。现象:干燥的布条不褪色,湿润的布条褪色。
【推理】褪色原因:氯气遇水后,反应得HCl、HClO。干燥的布条不褪色说明Cl2不能使布条褪色,已知H2O、HCl不能使布条褪色,所以HClO使布条褪色。
(1)结论:HClO有漂白作用。
(2)能漂白的原因:HClO有更强的氧化性。
(3)什么是漂白:使某些染料或有机色素褪色。
SO2使紫色的酸性KMnO4溶液褪色,这不是漂白。
2、有强氧化性。
HClO中Cl(+1)不稳定,易生成Cl(-1),显示为强氧化性。
与Na2SO3溶液反应:Na2SO3+HClO=Na2SO4+HCl
3、有酸性、弱酸性,比碳酸的酸性还弱。
(1)与NaOH中和:HClO+NaOH=NaClO+H2O
(2)NaClO与稀硫酸反应:2NaClO+H2SO4=2HClO+Na2SO4
(3)Ca(ClO)2溶液中通入CO2:
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
4、不稳定。
HClO中Cl(+1)不稳定,易生成Cl(-1)。
【推理】2HClO 2HCl+O2↑
2HCl+O2↑
5、HClO因为有强氧化性,还有杀菌消毒能力。
NaClO溶液、Ca(ClO)2溶液也有杀菌消毒能力,因为它们的溶液中都含有HClO。
6、关于NaClO、Ca(ClO)2的失效:
①密封失效:发生分解反应,如2NaClO=2NaCl+O2↑。
②漏气失效:先和空气中的H2O、CO2生成HClO,然后HClO见光分解。
7、关于验证HClO光照分解产物的数字化实验
(1)什么是数字化实验?利用传感器和信息处理终端进行实验数据的采集与分析的实验。
(2)通过三张图分析出反应过程中,H+浓度、Cl-浓度、O2的体积分数都在增加,说明有HCl和O2生成。
三、氯气的实验室制法
1、舍勒的软锰矿(MnO2)与浓盐酸加热制氯气
【推理】MnO2+4HCl(浓) Cl2↑+MnCl2+2H2O
Cl2↑+MnCl2+2H2O
2、将教材中的装置改为
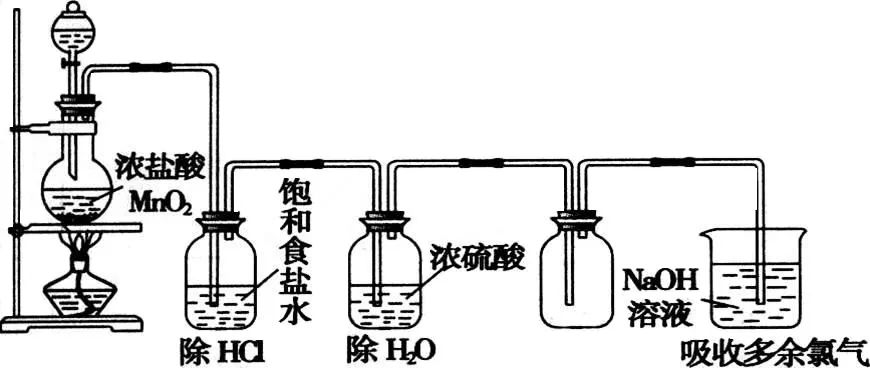
认识分液漏斗和圆底烧瓶,注意分液漏斗加液体的优点。
3、除去Cl2中的HCl用饱和食盐水。
原因是Cl2的溶解度小,HCl的溶解度极大。水能溶解HCl,饱和食盐能降低Cl2的溶解。
【推理】为什么不能用饱和NaHCO3?与Cl2反应,且生成新杂质CO2。
4、还可以用KMnO4固体与浓盐酸常温下反应制取Cl2。
【推理】KMnO4+16HCl(浓)=5Cl2↑+2MnCl2+2KCl+8H2O
气体发生装置中没有酒精灯。
四、Cl-的检验
【实验】稀盐酸、NaCl溶液、Na2CO3溶液、自来水、蒸馏水与AgNO3溶液、稀HNO3的反应
1、初中学过,用稀HNO3和AgNO3溶液。
按教材规范一下操作步骤:先加稀HNO3,再加AgNO3溶液。
现象和结论:若有白色沉淀出现,则溶液中有Cl-。
2、稀HNO3的作用:
防止CO32-等离子的干扰。
3、氯化物的化学性质
(1)在水溶液中呈现为Cl-。
性质之一:Ag++ Cl-=AgCl↓
(2)性质之二:Cl-有还原性。
【推理】2NaCl+2H2SO4(浓)+MnO2 Cl2↑+MnsO4+Na2SO4+2H2O
Cl2↑+MnsO4+Na2SO4+2H2O
五、增加内容:
1、Cl2与热的NaOH溶液反应
3Cl2+6NaOH 5NaCl+NaClO3+3H2O
5NaCl+NaClO3+3H2O
2、NaClO或KClO3的强氧化性
与浓盐酸反应制Cl2
NaClO+2HCl(浓)= Cl2↑+NaCl+H2O(84消毒液与洁厕灵不能混合使用)
KClO3+6HCl(浓)= 3Cl2↑+KCl+3H2O
六、学科核心素养的培养
1、氯气的发现与命名
长达三十多年,数位科学家。
好奇心、求知欲、执着、持之以恒。
为什么对科学家称之为“伟大的”?
2、氯气的应用与毒害
辩证法、矛盾论:化学品使用的理性思考。

- 全部评论(0)
