氯及其化合物问题集
时间:2024-01-16 17:18 来源:未知 作者:Chem哥 点击:次 所属专题: 氯及其化合物
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1.氯气有毒,为什么还用于消毒
氯气有毒,所以能消毒
2.为什么HF到HI酸性增强,HClO4到HIO4酸性减弱?
F、Cl、Br、I同一主族,可用元素周期律解释。F到I半径增大,卤素原子与H之间的作用力减弱,H+更易电离出来,酸性增强。F半径最小,F与H之间作用力最大,就很难电离出氢离子,所以HF是弱酸。I半径最大,与H结合最不牢固,最易电离出H+,酸性最强。
HClO4、HBrO4、HIO4是非金属最高价的含氧酸,由非金属性决定。非金属性越强,最高价氧化物对应水化物的酸性越强。
3.F2氧化性强于氯气,为什么不能将NaCl中的Cl置换出来?
F是非金属最强的元素,F2的氧化性当然很强。置换出Cl2当然不在话下,奈何溶液中水太多,直接和水反应了,Cl-没有机会和F2接触。2F₂ + 2H₂O = 4HF+ O₂
想想金属Na投入CuSO4溶液中是不是也是这样。
4.为什么用饱和食盐水除氯气中的氯化氢?
HCl极易溶于水,除HCl首先想到水,但同时还要考虑另外气体是否溶于水。氯气要溶于水,且与水反应,所以单纯的水不行,而饱和食盐水不仅可以溶解HCl,又几乎不溶解氯气。
同理,除去CO2中的HCl用饱和NaHCO3溶液也是为了减小CO2在水中的溶解。
H2等难溶于水的气体中混有HCl,用水除去便可以了。
5.氯气是否会燃烧
氢气与氯气反应,我们一般说是氢气在氯气中燃烧,氢气(还原剂)作燃料,氯气(氧化剂)作助燃剂。
6.氢气在氯气中燃烧瓶口为什么有白雾?
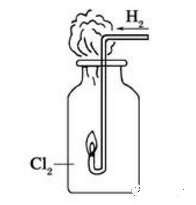
反应生成氯化氢气体,由于氯化氢极易溶于水,连空气中的水蒸气都不放过,白雾是氯化氢与水结合形成的盐酸小液滴。
7.漂白粉和漂白液有什么区别?
漂白粉有效成分是次氯酸钙Ca(ClO)2,漂白液有效成分是NaClO。漂白原理是相同的,与空气中CO2反应生成次氯酸,进而漂白。(溶液中的ClO-本身也具有较强的氧化性,具有漂白性)。
8.氯气、次氯酸钠,次氯酸钙本身是否具有漂白性?
高中阶段的多数资料会说上述物质真正起漂白作用的是反应生成的次氯酸。因为次氯酸具有超级强的氧化性,比高氯酸还强。(具体原因不展开,记住强氧化性可以漂白、杀菌消毒就行)
实验发现干燥的氯气不能使干燥的有色布条褪色,湿润的则行。可以说明是次氯酸具有漂白性,不是氯气。
漂白粉、漂白液漂白原理一定是因为与二氧化碳(碳酸)反应生成次氯酸吗?空气中二氧化碳含量只有0.03%,生成次氯酸恐怕有点久。资料显示碱性环境下ClO-也具有漂白性(碱性环境下CO2没法生成次氯酸),因此ClO-本身也应该具有漂白性。当然酸性环境下的HClO氧化性会更强,漂白效果更好。
9.工业制漂白粉为什么用石灰乳,不用石灰水?
Ca(OH)2微溶于水,石灰水中Ca(OH)2含量太少。同理,处理氯气、二氧化硫也不用石灰水。
10.非金属最高价氧化物的水化物酸性为什么可以作为非金属性强弱的判断依据?
非金属性越强,最高价氧化物对应水化物酸性越强,反之也成立。
这可能经验总结吧。
11.碘化钾试纸可以检验所有有氧化性的气体吗?

先纠正:是碘化钾淀粉试纸。碘化钾淀粉试纸检验气体的原理的是,碘离子I-被氧化为碘单质I2,淀粉遇I2变蓝。所以氧化性要比I2强的气体才能检验,如常见的Cl2,Br2,O3。
12.氯气给自来水消毒存在弊端吗?
氯气消毒会产生一些危害人体健康的副产物。如三氯甲烷、氯代乙酸、氯代乙腈和致诱变化合物,像三氯甲烷这些副产物具有致癌作用。
当然,任何科学技术都应看到它的两面性。自1850年氯气首次用于供水消毒以来,它在预防水介性病原微生物传染性疾病,保障公众饮水安全起着举足轻重的作用。目前氯气仍然是我国自来水消毒的主流,随着科技发展,更安全的ClO2,O3,紫外消毒正在发展。
13.检验氯离子为什么要加硝酸酸化?
Ag2CO3、AgOH也是难溶的,硝酸可以排除CO32-、OH-等离子的干扰。
想一想能不能用盐酸、硫酸酸化?
14.资料上写氯气表现氧化性和既表现氧化性又表现还原性,有只表现还原性的时候吗?
氯气单质为0价,理论上化合价既可以升高,也可以降低,既具有氧化性也具有还原性。但以氧化性为主。
具体体现在,遇到不具有还原性的物质时候,氯气自身氧化自身还原,发生歧化反应。
Cl2+H2O=HCl+HClO
(注:当然H2O并非没有还原性,比如遇到氧化性超强的F2,会体现出还原性,生成O2,通常水中的氢氧元素还是很稳定的,不考虑其氧化性还原性)
Cl2+2NaOH=NaCl+NaClO+H2O
氯气遇到具有还原性的物质,氯气则只体现氧化性
Cl2+2I-=I2+2Cl-
Cl2+2Fe2+=2Cl-+2Fe3+
氯气一般不单独体现还原性。不过理论上遇到氧化性更强的物质会体现出还原性,如与F2反应会生成ClFX。
想一想,是不是有点像Na2O2。
15.怎样检测氯水pH

氯水中的次氯酸由于具有漂白性,所以pH试纸检测会被漂白,测不准确。可以用pH计。
16.二氧化锰与浓盐酸反应,如果二氧化锰过量,浓盐酸就可以全部消耗掉吗?
纠正问题:应该问氯化氢可以被全部消耗掉吗?
不能,随着反应进行,HCl浓度降低,反应会停止。
17.氯气使湿润的蓝色石蕊试纸先变红后褪色,既然盐酸和次氯酸同时生成,为什么不是直接褪色?
酸使石蕊变色更迅速,次氯酸使之褪色所需时间更长。
18.实验室制取氯气,尾气处理为什么不能用石灰水?
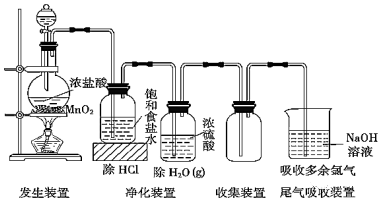
Ca(OH)2溶解度低,吸收不完全,用溶解度更大的氢氧化钠的溶液吸收。
19.为什么强氧化性的次氯酸能杀死细菌,是不是具有强氧化性物质都能杀死细菌?
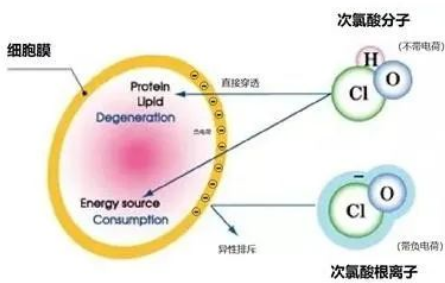
HClO与ClO-的杀菌原理差异
强氧化性物质能使蛋白质变性,通常都具有杀菌效果。
次氯酸作用时,会反应产生中间活性物质,使微生物的酶系蛋白质中的氨基酸氧化分解而失去活性。次氯酸在杀菌、杀病毒过程中,不仅可作用于细胞壁、病毒外壳,而且因次氯酸分子小,电中性,还可渗透入菌(病毒)体内,与菌(病毒)体蛋白、核酸、和酶等有机高分子发生氧化反应,从而杀死病原微生物。
20.硅酸和次氯酸哪个更弱?
(原)硅酸。这两种酸都比碳酸弱。
比较酸性强弱,可以根据酸的电离常数。(参考选修四电离常数)
HClO的电离常数K=2.9×10-8,原硅酸H4SiO4电离常数K=2.51×10-10(第一级电离)。电离常数越小,酸越难电离出H+,酸性越弱。
21.次氯酸的弱酸性在某些方面有用途吗?
消毒时候不用太担心腐蚀性太强吧。
22.卤素是什么?
卤素一词源自希腊文,有生成盐的意思,最早因发现氯能与金属直接化合生成盐而得名。后来逐渐发现与氯类似的元素还有氟、溴、碘和砹。均为Ⅶa族元素。
23.为什么次氯酸HClO是弱酸,氯酸HClO3、高氯酸HClO4是强酸。
同一非金属元素含氧酸,该非金属元素化合价越高,酸性越强。
含氧酸的酸性由羟基电离出H+体现出来。中心非金属原子化合价越高,对羟基的电子吸引力更强,羟基更容易电离出H+。
24.F2、Cl2、Br2、I2与氢气反应条件相同吗?
卤素单质化学性质比较
单质 | 跟H2反应和生成 氢化物的稳定性 | 跟水反应 |
F2 | 冷暗处发生剧烈反应而发生爆炸, HF很稳定 | 迅速反应 |
Cl2 | 强光照射下,剧烈反应而爆炸, HCl较稳定 | 日光照射下,缓慢反应 |
Br2 | 高温条件下,较慢化合, HBr较不稳定 | 反应更缓慢 |
I2 | 持续加热,缓慢化合, HI很不稳定,同时发生分解 | 反应微弱 |
非金属性越强,越容易与氢气化合,形成的物质越稳定。(参考必修二元素周期律)
25.为什么漂白粉不能漂白蚕丝、羊毛织品?
蚕丝、羊毛主要成分为蛋白质,漂白粉漂白利用的强氧化性,会使蛋白质变性、泛黄。
26.用什么干燥、净化氯气?
氯气溶于水显酸性,所以不能用碱性干燥剂。可以用酸性或中性干燥剂,如浓硫酸、无水氯化钙、硅胶等。
净化要看混的什么杂质。
27.实验室制取氯气为什么要用浓盐酸?
稀盐酸不与二氧化锰反应。
如果用高锰酸钾,则可以用稀盐酸,且不需要加热。这里体现出高锰酸钾氧化性强于二氧化锰。
2KMnO₄+16HCl=2KCl+2MnCl₂+5Cl₂↑+8H₂O
28.如果MnO2过量,浓盐酸就会被消耗完吗?
不会,浓盐酸终究会变稀。如果浓盐酸过量,可以使MnO2消耗完。

- 全部评论(0)
