均摊法确定晶体结构
时间:2016-01-30 14:56 来源:未知 作者:毛远明 点击: 次 所属专题: 均摊法 晶体结构计算
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
晶体结构是中学化学的基本理论之一,指的是各粒子组成晶体时粒子的空间排布方式,是晶体的微观结构。在历年的高考试题中,晶体结构的推断及相关计算是出现的热点之一。而这又往往是拉开学生分数差距的难点,它要求学生有较强的空间想象能力和较好的数学运算能力,推理要逻辑严密,思维要完整准确。
从微观角度讲,构成物质的粒子,除了相互间有一定的作用力外,这些粒子还有一定的空间排布规律,即一定数目的粒子组成一定的空间结构或构型。晶体可被切割成若干个相同的基本单元,这些基本单元中的点、线、面都被若干相同的基本单元共用,故而每个基本单元只分割了几分之一个点、线、面。因此可以用均摊的方法来确定晶体的化学式。均摊是指每个图形平均拥有的粒子的数目。因而晶体中粒子的个数比可用如下方法求得:

如图:
(1)处于顶点上的粒子D,同时为8个基本单元所共用,
每个粒子D只有1/8属于该单元;
(2)处于棱上的粒子C,同时为4个基本单元所共用,
每个粒子C只有1/4属于该单元;
(3)处于面心上的粒子D,同时为2个基本单元所共用,
每个粒子D只有1/2属于该单元;
(4)处于基本单元中心的粒子C,则完全属于该单元。
所以,上图中的有C粒子:12×![]() +1=4,D粒子:8
+1=4,D粒子:8![]() +6
+6![]() =4,所以该晶体中C、D粒子的个数比为4:4=1:1,
=4,所以该晶体中C、D粒子的个数比为4:4=1:1,
例题1:1986年,在瑞士苏黎士工作的两位科学家发现了一种性能良好的金属氧化物超导体使超导研究工作取得突破性进展,为此两位科学家获得了1987年的诺贝尔物理学奖,其晶胞结构如图所示。答下列问题:
(1)根据图所示晶胞结构,推算晶体中Y、Cu、Ba、O的原子个数比,确定其化学式 ;
(2)根据(1)所推出的化合物的组成,计算其中Cu原子的平均化合价(该化合物中各元素的化合价为Y:+3、Ba:+2、Cu:+3、Cu:+2),试计算化合物中这两种价态的Cu原子的个数比 。

【解析】由图可知,Y、Ba原子处于晶胞内,其数目分别为1、2,Cu原子有8个处于晶胞顶点,8个处于晶胞的棱边上,其总数为8![]() +8
+8![]() =3,O原子有12个处于晶胞的棱边上,8个处于晶胞的面上,其总数为
=3,O原子有12个处于晶胞的棱边上,8个处于晶胞的面上,其总数为![]() =7,所以晶胞中Y、Cu、Ba、O的原子个数比为1:3:2:7,其化学式为YCu3Ba2O7。
=7,所以晶胞中Y、Cu、Ba、O的原子个数比为1:3:2:7,其化学式为YCu3Ba2O7。
设Cu元素的平均化合价为x,由化合物中各元素正、负化合价代数和为0,可得:
1 ×(+3)+2×(+2)+3×x+7×(-2)=0 x=+![]()
再用十字交叉法或设未知数解,设+2 Cu个数为a, +3 Cu个数为3-a, 则有![]() ,得a=2,所以Cu +2,Cu +3的原子个数比为2:1。
,得a=2,所以Cu +2,Cu +3的原子个数比为2:1。

例题2:2001年报道硼和镁形成的化合物刷新了金属化合物超导高温的最高记录。图为该化合物的晶体结构:镁原子间形成正六棱柱,且棱柱的上下底面还各有一个镁原子;6个硼原子位于棱柱内。则该化合物的化学式可表示为 。
【解析】 12个镁原子位于六棱柱的顶点,2个镁原子位于上下底面,所以共有镁原子![]() ,(位于六棱柱顶点上的镁原子为6个六棱柱所共用,所以每个六棱柱只分摊到
,(位于六棱柱顶点上的镁原子为6个六棱柱所共用,所以每个六棱柱只分摊到![]() 个镁原子),硼原子位于六棱柱内,所以有硼原子6个,镁、硼原子个数比为1:2,该化合物的化学式可表示为MgB2。
个镁原子),硼原子位于六棱柱内,所以有硼原子6个,镁、硼原子个数比为1:2,该化合物的化学式可表示为MgB2。
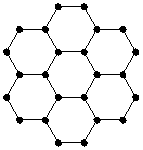
例3、石墨晶体中每一层为正六边形的平面网状结构(如图),则每个正六边形占有 个碳原子, 个C—C键,碳原子与C—C键的个数之比是 。
【解析】:此结构中正六边形顶点为碳原子,边即为C—C键。构成一个正六边形环状结构需要6个顶点、6条边;而每个顶点由3个正六边形共用,所以每个六边形占有6![]() =2个碳原子;每条边由2个正六边形共用,每个环所占的C—C键有
=2个碳原子;每条边由2个正六边形共用,每个环所占的C—C键有![]() =3个,两者比值为2:3。
=3个,两者比值为2:3。
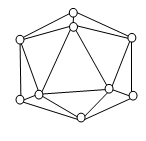
例4、晶体硼的基本结构单元都是由硼原子组成的正二十面体的原子晶体。(入图)其中含有20个等边三角形和一定数目的顶角,每个顶角上各有一个原子。试推断这个基本结构单元所含有的硼原子的个数为 ,含有的B—B键的个数为 个。
若将晶体硼结构单元中的每一个顶角削去,余下部分结构与C60的结构相同,则C60由 个正六边形和 个正五边形构成。
【解析】:由图可以看出,每个顶角上的硼原子被5个三角形共用,所以每个三角形占有的硼原子个数为![]() 个,所以硼原子的总数是
个,所以硼原子的总数是![]() =12个。B—B键即为三角形的棱边,每条边为2个三角形共用,所以每个三角形占有的B—B键为
=12个。B—B键即为三角形的棱边,每条边为2个三角形共用,所以每个三角形占有的B—B键为![]() =
=![]() ,所以B—B键的总数为
,所以B—B键的总数为![]() =30个。削去一个顶角就形成一个五边形,而原有的三角形就形成一个正六边形,故可以形成20个正六边形和12个正五边(有12个硼原子即12个顶点)。
=30个。削去一个顶角就形成一个五边形,而原有的三角形就形成一个正六边形,故可以形成20个正六边形和12个正五边(有12个硼原子即12个顶点)。

- 全部评论(0)
