各种酸碱中和滴定曲线图的认识与应用
时间:2017-06-29 16:48 来源: 作者:毛远明 点击:次 所属专题: 中和滴定曲线
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
近年高考频繁出现酸碱中和滴定的图象题,此类题试题综合性强,难度较大,不仅考查学生定性与定量结合分析问题的思想,而且考查学生数形结合识图用图的能力,还要求学生能深入微观世界认识各种化学过程来解决比较微粒浓度大小问题。但万变不离其中,离不开指示剂的选择,离不开滴定曲线的认识与应用,离不开电离平衡、水解平衡与三守恒(电荷守恒、物料守恒、质子守恒)分析比较离子浓度大小等问题。
滴定曲线的认识与应用:酸碱中和滴定曲线图是以所滴入的酸或碱溶液的体积为横坐标、以中和反应后溶液的pH为纵坐标体现中和滴定过程的曲线图。
强酸与强碱互相滴定的曲线图,前半部分与后半部分形状变化不大,但中间突跃大(即酸或碱溶液一滴之差,溶液pH变化大,出现突变)。分析强酸与强碱互相滴定时的离子浓度大小,只要关注水的电离平衡即可,没有其它平衡影响。
强酸滴定弱碱或强碱滴定弱酸的曲线图,突跃小,较平缓;强酸滴定弱碱的起点低(因弱碱pH相对较小),前半部分形状有差异;强碱滴弱酸的起点高(因弱酸pH相对较大),前半部分形状有差异。分析强碱滴定弱酸或强酸滴定弱碱时的离子浓度大小,不仅要考虑生成盐的水解平衡,而且还要考虑过量弱酸或弱碱的电离平衡与水的电离平衡。
指示剂选择的原则:指示剂的选择不但要考虑变色明显、灵敏,而且要选择指示剂的变色范围与滴定时pH突跃范围相吻合,这样就能准确指示到达滴定终点(即酸碱恰好中和时的pH)。
一、强酸强碱互相滴定曲线图的应用
例1.下图曲线a和b是盐酸与氢氧化钠的相互滴定的滴定曲线,下列叙述正确的是( )
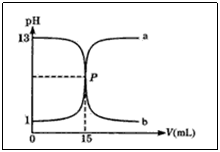
A.盐酸的物质的量浓度为1.0mol·L-1
B.P点时反应恰好完全,溶液呈中性
C.曲线a是盐酸滴定氢氧化钠的滴定曲线
D.酚酞不能用作本实验的指示剂
解析:认识滴定曲线图是解题的关键,强酸与强碱相互滴定突跃大,且恰好中和时溶液pH=7,故酚酞、甲基橙均可作指示剂。识图:滴定前pH=1;c(HCl)=0.1mol·L-1,pH=13,c(NaOH)=0.1mol·L-1。显然a曲线为NaOH溶液滴定盐酸的曲线,曲线b为盐酸滴定NaOH溶液的曲线,P点表示盐酸与氢氧化钠恰好完全中和,溶液呈中性,唯b正确。
二、强酸滴定弱碱曲线图的应用
例2.(2016全国高考I卷12)298K时,在20.0mL0·10mol·L-1氨水中滴入0.10mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10 mol·L-1氨水的电离度为1.32%,下列有关叙述正确的是(
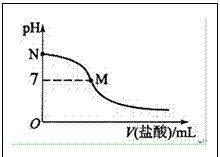
A.该滴定过程应该选择酚酞作为指示剂
B.M点对应的盐酸体积为20.0mL
C.M点处的溶液:c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D.N点处的溶液中pH<12
解析:强酸滴定弱碱的突跃小,且恰好中和时溶液处于弱酸性(生成的强酸弱碱盐水解呈酸性),故盐酸滴定氨水时应选择酸性范围内变色的甲基橙为指示剂,A错。氨水与盐酸恰好完全反应生成的NH4Cl水解显弱酸性,pH<7,故pH=7的M点对应的盐酸体积应该小于20.0mL,B错。由电荷守恒知,M点溶液)c(H+)=c(OH-) c(NH4+)=c(Cl-),c(NH4+)=c(Cl-)≠c(H+)=C(OH-),故C错。N点是未滴定前的氨水,c(OH-)=0.10 mol·L-1×1.32%=1.32×10-3 mol·L-1,pH=11+lg1·32<12,故D正确。
例3.在常温下,0.1000mol·L-1Na2CO3溶液25mL 用0.1000mol·L-1盐酸滴定,其滴定曲线如图所示。对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是( )
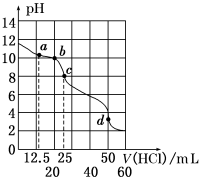
①a点:c(CO32-)>c(HCO3-)>c(OH-)
②b点:c(Cl-)>c(HCO3-)+c(CO32-)
③c点:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
④d点:c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
A.①② B.②③
解析:用盐酸滴定Na2CO3溶液依次反应为:HCl+Na2CO3==NaHCO3+NaCl,HCl+NaHCO3==H2CO3+NaCl。显然,a、b、c点盐酸不足,均按第一个反应进行,d点二者恰好完全反应,按两个反应进行。a点滴入12.5mL 盐酸反应后得到等量Na2CO3和NaHCO3的混合溶液,因CO32-水解程度大于HCO3-,故c(CO32-)<c(HCO3-),①错。b点滴入20mL 盐酸反应后得到NaHCO3、NaCl、Na2CO3的混合溶液,HCl与Na2CO3的物质的量之比为4∶5,由物料守恒知:5c(Cl-)=4c(HCO3-)+4c(CO32-)+4c(H2CO3),故②正确。c点滴入25mL 盐酸反应后溶质为NaHCO3和NaCl,由质子守恒知c(OH-)+c(CO32-)=c(H+)+c(H2CO3),③错。d点滴入50mL 盐酸反应后溶质为NaCl和H2CO3,由电荷守恒知c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)+c(Cl-),因c(Na+)=c(Cl-),故④正确。正确答案为D。
三、强碱滴定弱酸曲线图的应用
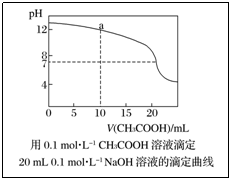
例4.常温下,用0.1000mol·L-1NaOH溶液滴定20.00mL0·1000mol·L-1CH3COOH溶液,滴定曲线如图。下列说法正确的是( )
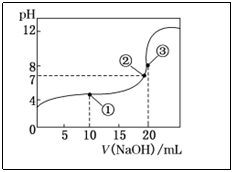
A.点①所示溶液中c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
B.点②所示溶液中c(Na+)=c(CH3COOH)+c(CH3COO-)
C.点③所示溶液中c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D.滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
解析:强碱滴定弱酸的突跃小,且恰好中和时溶液处于弱碱性(生成的强碱弱酸盐水解呈碱性),若选择指示剂,只能选择碱性范围内变色的酚酞。识图:滴定曲线中的点①处是滴入10.00mL NaOH溶液中和后得到等量的CH3COOH与CH3COONa的混合溶液,由电荷守恒知:
c(CH3COO-)+c(OH-)=c(Na+)+c(H+),CH3COOH的电离程度大于CH3COONa的水解程度c(Na+)>c(CH3COOH),A错;点②处是pH=7的CH3COONa与少量CH3COOH的混合溶液,c(OH-)>c(H+),由电荷守恒知c(Na+)c(CH3COO-),B错;点③处是CH3COONa的弱碱性溶液c(CH3COO-)>c(OH-),C错;点①之前加入少量的NaOH溶液时,可以得到少量CH3COONa与较多量CH3COOH的混合溶液,离子浓度会出现c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-),正确答案为D。
例5.(2013浙江高考)25 ℃时,用浓度为0.1000 mol·L-1的NaOH溶液分别滴定20.00mL 浓度均为0.1000mol·L-1的三种酸HX、HY、HZ,滴定曲线如图所示。下列说法正确的是( )
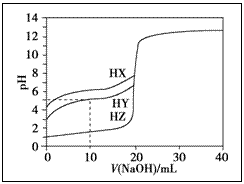
A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:HX<HY<HZ
B.根据滴定曲线,可得Ka(HY)≈10-5
C.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至Hx恰好完全反应时:
c(X-)>c(Y-)>c(OH-)>c(H+)
D.HY与HZ混合达到平衡时c(H+)=[Ka(HY)·c(HY)/c(Y-)]+c(Z-)+c(OH-)
解析:识图:滴定曲线的突跃越大的酸,其酸性越强。在相同温度下,同浓度的三种酸溶液的酸性:HX<HY<HZ,故导电能力:HX<HY<HZ,A错;当pH=5时,10.00mL NaOH溶液滴定等浓度的HY溶液,得到等量的HY与NaY的混合溶液,由于溶液c(H+)=10-5mol·L-1 c(Y-)≈C(HY), Ka(HY)=c(H+)·c(Y-)/c(HY)≈10-5,B正确;当HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好反应时,得到等量的NaY与NaX,由于X-水解程度大于Y-,故Y-的浓度应大于X-,C错;当HY与HZ混合达平衡时,由电荷守恒知c(H+)=c(Y-)+c(Z-)+c(OH-),c(Y-)=Ka(HY)·c(HY)/c(H+),D错。正确答案为B。
四、现场体验
1.(2015山东高考)室温下向10mL0·1mol·L-1NaOH溶液中加入0.1mol·L-1一元酸HA溶液,pH的变化曲线如图所示。下列说法正确的(
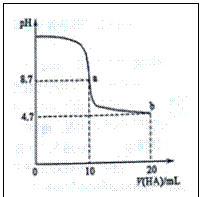
A.a点所示溶液c(Na+)>c(A-)>c(H+)>c(HA)
B.a、b两点所示溶液中水的电离程度相同
C.pH=7时,c(Na+)=c(A-)+c(HA)
D.b点所示溶液c(A-)>c(HA)
2.下列有关溶液中粒子浓度的关系式,正确的是( )
A.pH相同的①CH3COONa、②NaHCO3、③C6H5ONa三种溶液中c(Na+):③>②>①
B.0.1mol·L-1某二元弱酸强碱盐NaHa溶液中c(Na+)=2c(A2-)+c(HA-)+c(H2A)
C.下图中pH=7时c(Na+)>c(CH3COO-)>c(OH-)=c(H+)
D.上图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH)
3.20℃时向20mL0·1mol·L-1醋酸溶液中不断滴入0.1mol·L-1NaOH溶液,溶液pH变化如图所示。此过程中溶液中离子浓度的关系错误的是( )
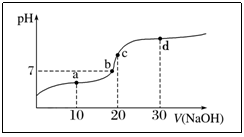
A.a点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B.b点:c(Na+)=c(CH3COO-)>c(H+)=c(OH-)
C.C点:c(H+)=c(CH3COOH)+c(OH-)
D.D点:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
4.(2015诸城模拟)现有常温下甲、乙、丙三种溶液,甲为0.10mol·L-1 的NaOH溶液,乙为0.10 mol·L-1的HCl溶液,丙为0.10mol·L-1的CH3COOH溶液,试回答下列问题:
(1)甲溶液的pH=________。
(2)丙溶液中存在电离平衡为_________________ (用电离平衡方程式表示)。
(3)甲、乙、丙三种溶液中由水电离出c(OH-)的大小关系为______
(4)某同学用甲溶液分别滴定20.00mL 乙溶液和20.00mL 丙溶液,得到如图所示两条滴定曲线,请完成有关问题:
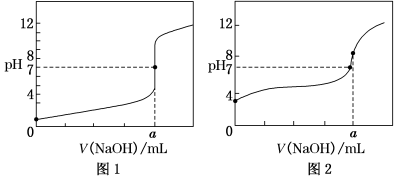
①甲溶液滴定丙溶液的曲线是______(填“图1”或“图2”);
②a=________mL。
5.现有25℃时0.1mol·L-1的氨水和0.1mol·L-1的NaOH溶液,若向各20mL 的氨水和NaOH溶液中分别滴加0.1 mol·L-1的稀盐酸,滴定曲线如图所示,请回答以下问题。
(1)为减少误差,滴定氨水时宜选用
(2)计算25℃时此氨水的电离度α(NH3·H2O)=
(3)分析滴定曲线,下列说法正确的是
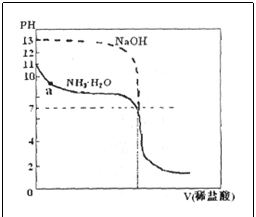
A.
B.
C.当滴到pH=7时,滴定氨水消耗V(盐酸)<20 mL,滴定NaOH消耗V(盐酸)=20 mL
D.当滴定氨水消耗V(盐酸)20mL 时,一定有c(Cl-)>c(NH4+)>c(H+)>c(OH-)
(4)当在浓度均为0.3mol·L-1的氯化铵和氨水的混合溶液中滴加少量稀盐酸或稀NaOH溶液,发现溶液的pH几乎不变,其原因是
五、参考答案:
1.D
4.(1)13  CH3COO-+H+ H2O
CH3COO-+H+ H2O OH-+H+ (3)丙>甲=乙
OH-+H+ (3)丙>甲=乙
5.(1)甲基橙
(4) 在氯化铵和氨水的混合溶液中存在平衡:NH4++H2O NH3·H2O+H+,NH3·H2O
NH3·H2O+H+,NH3·H2O NH4++OH-,当向混合液中加入少量酸溶液时,氯化铵的水解平衡向左移动,氨水的电离平衡向右移动c(H+)增加不大;当向溶液中加入少量碱溶液时,氯化铵的水解平衡向右移动,氨水的电离平衡向左移动c(OH-)增加不大。因此,当加入少量酸或碱时溶液的pH几乎不变。
NH4++OH-,当向混合液中加入少量酸溶液时,氯化铵的水解平衡向左移动,氨水的电离平衡向右移动c(H+)增加不大;当向溶液中加入少量碱溶液时,氯化铵的水解平衡向右移动,氨水的电离平衡向左移动c(OH-)增加不大。因此,当加入少量酸或碱时溶液的pH几乎不变。

- 全部评论(0)
