盐类水解反应的离子方程式书写
时间:2012-05-16 15:11 来源:未知 作者:刘玉林 点击:次 所属专题: 盐类水解方程式
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
正确书写盐类水解反应的离子方程式之一
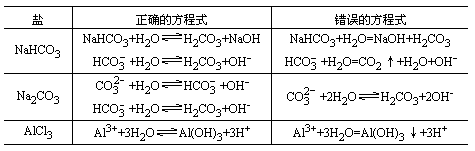
书写盐类水解的反应的离子方程式的关键是写出弱酸根阴离子或不活泼金属阳离子(包括铵离子)与水反应生成相应弱酸或弱碱的反应式.书写盐类水解反应的离子方程式应注意以下几点:
(1)写盐类水解的离子方程式时,应遵循书写离子方程式的规律,强电解质要写成离子形式,弱电解质要写成分子形式,盐要写成离子形式,水必须写成分子形式.例如CH3COONa水解反应的离子方程应是CH3COO-+H2O![]() CH3COOH+OH-,而不能写成CH3COO-+H+=CH3COOH
CH3COOH+OH-,而不能写成CH3COO-+H+=CH3COOH
(2)应区别盐类反应的离子方程式和盐类水解反应的平衡电离方程式:
CH3COONa水解的平衡电离方程式是:
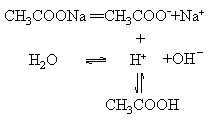
用这种形式表示盐类的水解,不仅能反映出盐类水解的本质,而且可以清楚地看出盐类水解时所形成的各种平衡.但是这不是盐类水解反应的离子方程式.水解的离子方程式应是
CH3COO-+H2O![]() CH3COOH+OH-
CH3COOH+OH-
(3)多元弱酸的盐和多元弱碱的盐在水解时是分步的,写离子方程式时应分步写,因为每一步水解的程度是不同的,第一步水解的程度最大.如果没有特别要求,多价金属离子的水解可以一步写出水解的最终产物,但多元弱酸根离子的水解必须分步写出.例如:
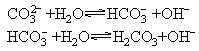
(4)大多数盐类的水解反应是可逆的,方程式中应写可逆符号“![]() ”,在可逆的离子反应中,生成的H2S、H2CO3不挥发不分解,不离开平衡体系,Fe(OH)3、Al(OH)3等不沉淀,因此方程式中这些物质的化学式旁不用标箭头.
”,在可逆的离子反应中,生成的H2S、H2CO3不挥发不分解,不离开平衡体系,Fe(OH)3、Al(OH)3等不沉淀,因此方程式中这些物质的化学式旁不用标箭头.
少数几种盐在水解时能进行到底,离子方程式中应用等号,生成物中析出沉淀或放出气体(当气体溶解度不大时).例如Al2S3和Al2(CO3)3的水解:
2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑
![]()
正确书写盐类水解反应的离子方程式之二
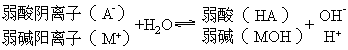
书写要点:用可逆符号(![]() ),不标生成物的气体标号(↑)或沉淀符号(↓),不稳定的物质不能拆开写.
),不标生成物的气体标号(↑)或沉淀符号(↓),不稳定的物质不能拆开写.
由高价金属阳离子(M3+)与极弱的弱酸阴离子组成的盐,由于双方水解相互促进趋于完成的如Al2S3等除外.
Al2S3+6H2O=2Al(OH)3↓+3H2S↑
此类型的盐在水溶液中不存在(在溶解性表中以“—”表示).此两类离子在水溶液中不能大量共存.离子方程式一定要写等号(=),标出生成物的状态(↑)或(↓),不稳定的物质要拆开写.符合此种情况的有:
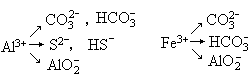
例如:FeCl3溶液与Na2CO3溶液反应的离子方程式为:
![]()
正确书写盐类水解反应的离子方程式之三
(1)是中和反应的逆反应,所以均吸热;
(2)大多为可逆反应,水解平衡;
(3)大多反应的程度很小,如CH3COONa溶液中主要成分仍是CH3COONa,因水解生成的CH3COOH和NaOH极少.
水解反应可用化学方程式和离子方程式来表示,书写时应注意:
(1)一般用“![]() ”
”
(2)一般无沉淀和气体(由于反应程度很小生成物很少)不写“↓”“↑”.
![]()

- 全部评论(0)
(2752580482) 评论 盐类水解反应的离子方程式:你好,氯化铁溶液和碳酸钠溶液反应的例子方程式里怎么钠和氯不在方程式里
