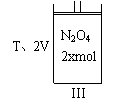化学平衡题的解题思想
时间:2020-02-16 10:38 来源: 作者:刘玉林 点击:次 所属专题: 化学平衡解题思维
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
化学平衡这部分内容是高中基础理论知识中最难理解的一部分,学生在学习中感到特别的困难。在平时的教学中,如若让学生形成一般思路可达到事半功倍的效果。解题中常用的解题思想有以下5种,现总结如下供同学们学习时参考:
(1)极端地分析化学平衡
化学平衡研究的是不能进行到底的可逆反应,为解决问题的方便,可以反其道而行之,假设反应能向某个方向进行到底,从而可以找到某量的最大、最小极限值,以此解决问题。
例1:在一定条件下,将A、B、C三种物质各1mol通入一个密闭容器中发生反应: 2A+B ![]() 2C,达到平衡时,B的物质的量可能是
2C,达到平衡时,B的物质的量可能是
A.1.5mol B.1mol C.0.5mol D.0
分析:现平衡往哪个方向进行不清楚,但可逆反应不能进行到底,故反其道而行之,假设反应能进行到底,从而找到B的物质的量的范围。
2A + B ![]() 2C
2C
起始:1mol 1mol 1mol
正向(到底): 0 0.5mol 2mol
逆向(到底): 2mol 1.5mol 0
因此B的物质的量在0.5mol~1.5mol之间,故应选B项。
(2)粗略到估算化学平衡
有些化学平衡题,可不必准确计算而推知答案。可以从平衡移动等方面判断某些量的关系,以此快速解答。
例2:在一个aL的密闭容器中,放入2LA气体和1LB气体,在一定条件下发生反应:3A(g)+B(g) ![]() nC(g)+2D(g),反应达平衡后,A的浓度减少到原来的1/2,混合气体的平均相对分子质量增大了1/8倍,则反应式中的n值为( )
nC(g)+2D(g),反应达平衡后,A的浓度减少到原来的1/2,混合气体的平均相对分子质量增大了1/8倍,则反应式中的n值为( )
A.1 B.2 C.3 D.4
分析:若按部就班地按常规方法解非常繁琐。若不准确计算,而从起始只加入了A和B,反应向正向进行,而最终相对分子质量增大了1/8倍,可知正反应方向是气体分子数增多的方向,故有3+1>n+2,得2>n,因此应选A项。
(3)适当地分割化学平衡
当一个密闭容器中存在2个或多个可逆反应时,可以单独研究每个可逆反应建立化学平衡,然后推出共同物质的量的关系而解决问题。
例3:一定条件下,在容积为2L的密闭容器里加入一定物质的量的A,发生如下反应并建立平衡:A(气)![]() 2B(气),2B(气)
2B(气),2B(气) ![]() C(气)+3D(气)。测得平衡时各物质的浓度是:c(A)=0.3mol/L,c(B)=0.2mol/L,c(C)=0.05mol/L。最初向容器里加入A的物质的量是( )
C(气)+3D(气)。测得平衡时各物质的浓度是:c(A)=0.3mol/L,c(B)=0.2mol/L,c(C)=0.05mol/L。最初向容器里加入A的物质的量是( )
A.0.5mol B.0.8mol C.0.9mol D.1.2mol
分析:此题有两个平衡同时存在且相互影响,可利用起始浓度与平衡的关系,将第二平衡的起始浓度当作第一平衡的平衡浓度,将两个可逆反应单独研究即可解决问题。

∴n(A)=0.45mol/L×2L=0.9。故选C。
(4)灵活地变换化学平衡
2个加入的物质及量完全相同的平衡,要比较2个平衡中的某个量的关系,可在不同的条件下进行思考,使一个平衡在改变该条件时变换为另一个平衡,根据平衡移动确定需研究的量的关系。
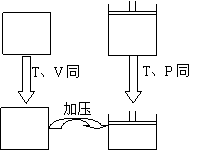
例4:体积相同的甲、乙两个容器中,分别都充有相同物质的量的SO2和O2,在相同温度下发生反应:2SO2(g)+O2(g)![]() 2SO2(g)并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为( )
2SO2(g)并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为( )
A.等于p% B.大于p% C.小于p% D.无法判断
分析:要比较这两个不同体系中SO2的转化率。这两个体系是加入的物质及量完全相同的平衡,先选取某平衡状态为标准平衡状态(参照标准),然后分析另一转变标准平衡状态的条件变化而引起平衡移动的结果,进行比较判定。
起始 甲 平衡 甲 |
| 起始乙 平衡乙 |
甲、乙起始完全相同,反应中甲体积不变,故压强减小;而乙压强不变,故体积减小。因此,乙平衡的结果与甲平衡后再加压的结果是相同的。故乙向正向进行程度比甲的程度大,故SO2转化率大于甲中SO2转化率,即应选B。
(5)巧妙地设计化学平衡
2个平衡中加入的物质相同,而与初始量是倍数关系时,可把量多者设计为2个或多个量少者等同的平衡,然后变换条件,得到符合条件的量多者的平衡,以此推知某些关系。
例5:把晶体N2O4放入一固定容积的密闭容器中气化并建立N2O4(g) ![]() 2NO2(g)平衡后,保持温度不变,再通入与起始时等量的N2O4气体,反应再次达平衡,则新平衡时c(NO2)/c(N2O4)与原平衡比,其比值( )
2NO2(g)平衡后,保持温度不变,再通入与起始时等量的N2O4气体,反应再次达平衡,则新平衡时c(NO2)/c(N2O4)与原平衡比,其比值( )
A.变大 B.变小 C.不变 D.无法确定
I N2O4 xmol | II N2O4 2xmol | |
|
| |
|
分析:加入的物质相同,而且是初始量是2倍,可把量多者设计为2个量少者等同的平衡体系(作参照标准)。若原体系加入N2O4物质的量为x(I图),则再通入后物质的量可看成是2x(II图),则可设计为III图。
可见,I图与III图中达平衡时,各组分的浓度、含量相同,但物质的量III是I中的2倍;比较I与II中关系,就变成了比较II与III中的关系了。只要将III加压体积缩小到V即可,加压的瞬间各组分浓度变成原来的2倍,但平衡再向逆向移动,使c(NO2)比原平衡时的浓度的2倍要小,而c(N2O4)比原平衡时的浓度的2倍要大,故比值变小。正确选项为B。

- 全部评论(0)