热点物质:联氨或肼的知识介绍
时间:2020-03-05 18:48 来源:未知 作者:骆传汉 点击:次 所属专题: 联氨 肼
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
联氨或肼(Hydrazine)(分子式:N2H4或H4N2,),是无色的剧毒化合物,常态下呈无色油状液体。气味类似氨,溶于水、醇、氨等溶剂,熔点20℃,沸点113.5℃,密度1.004克/厘米(25℃),在空气中能吸收水分和二氧化碳气体,并会发烟。肼和水能按任意比例互相混溶,形成稳定的水合肼N2H4·H2O。肼也与乙醇互溶,但不溶于乙醚和苯。肼的介电常数很高,液态肼的盐溶液能导电。肼是强还原剂,在碱性溶液中能将银、镍等金属离子还原成金属,可用于镜面镀银,在塑料和玻璃上镀金属膜。肼可由次氯酸钠和尿素或氨的反应制取。用于合成药物,偏二甲肼(CH3)2NNH2用作火箭燃料。肼能使锅炉内壁的铁锈变成磁性氯化铁层,可减缓锅炉锈蚀。
1、结构
| 球棍模型 | 比例模型 | |
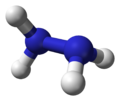 | 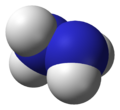 | 结构简式为H2N-NH2 |
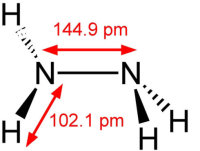
联氨的结构是从一对氨分子里各取一个氢原子然后把他们结合起来。每一个H2N-n(次单元是个金字塔)。H-N-H角为108°,N-n(键距离)1.45 Å,分子符合偏转构象。旋扭难度是乙醇的两倍。结构特性像气体双氧水。
2、性质
1、碱性
联氨的碱性仅为氨的15分之一。
N2H5++ H+ N2H62+
N2H62+
2、成盐
N2H4+HCl = N2H5Cl
N2H4是二元弱碱,若盐酸过量,第一步的产物可继续反应:
3、还原性
5N2H4+4KMnO4+6H2SO4== 5N2↑ + 4MnsO4+2K2SO4+16H2O
4、制取
可由次氯酸钠与氨反应制得。NaClO + 2NH3→ N2H4+NaCl + H2O
还可由氨、丙酮的混合物与氯气反应的产物水解制取,同时得到联氨和丙酮:
4NH3+(CH3)2CO+Cl2=(CH3)2C(N2H2)+2NH4Cl+H2O;(CH3)2C(N2H2)+H2O=(CH3)2CO+N2H4
5、用途
与四氧化二氮混合使用可当作火箭的燃料。N2O4+2N2H4→ 3N2↑ + 4H2O
压水堆核电机组启动时向一回路冷却剂中注入联氨以除去水中的氧: N2H4+O2= 2H2O + N2↑

- 全部评论(0)
(3036745759) 评论 热点物质:联氨或肼的知识:??????;;
