热点物质:探析分子“肼”之常见考点
时间:2020-03-05 18:41 来源:未知 作者:祝其君 点击:次 所属专题: 肼
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
作者:浙江省湖州市湖州中学弁山校区 于海强 于炎勇
肼又称联氨,分子式为N2H4,作为氮的重要 氢化合物,在各类高中化学试题中出现的频率很 高,已然成为明星分子,但高中教科书上偶见其 名,对其结构、性质等介绍几无涉及,试题中也往 往需要学生迁移应用。本文将简要介绍其相关知 识,并对其常见考点做一探析,以飨读者。
一、胼的知识简介
1.肼的结构特点
肼的结构简式为H2N-NH2,可看成是氨分 子中的一个氢原子被氨基取代的衍生物。肼分子是一种顺式结构,极性很大。在N2H4中每个N 原子上都有一对孤对电子,由于两个N原子上孤对电子的相互排斥,使得N-N键能减小),肼及其衍生物如偏二甲肼是一类重要的火箭高能燃料。 以此为信息,可考查肼的电子式、路易斯结构式, 氮原子的杂化方式,分子中键的类型(极性,非极 性,a键、7T键),分子的极性,肼的等电子体等。
2.肼的物理性质
纯净的联氨是无色髙吸湿性的液体,熔点 275K,沸点387K,能与水、甲醇、乙醇等混溶。以 此为信息,可考查沸点髙的原因,可以混溶的原因 (氢键作用、相似相容原理〉。
3.肼的化学性质
①弱碱性:联氨的水溶液呈碱性,其机理与氨 水相似,其强度比氨水弱。以此考查肼呈碱性的 原因,与硫酸等的反应、硫酸盐的晶体类型、化学 键种类等。
②氧化还原性:N2H4中N显-2价,既有氧 化性又有还原性,通常把肼用作强还原剂。以此 考查肼与N2O4、H2O2、O2等氧化剂的反应,如 N2O4 + 2N2H4=3N2 + 4H2O,还可以考查氧化还原相关概念、热化学方程式书写、燃料电池电 极反应方程式书写、应用氧化还原原理推断胼与 其他氧化剂反应的产物,如胼可以将氧化铜还原为氧化亚铜、和HNO2反应生成HN3等。
③配合性:N2H4中N原子上有孤对电子,因此肼可做为配体,如形成配合物[CO( N2H4) 6 ] Cl3 等,以此考查配合物相关概念、中心离子、配体、配 位原子、配位数等。
4 .肼的主要制备方法
方法1:用次氯酸钠与氨反应制得:NaC1O+2NH3 =N2H4 + NaCl + H2O
方法2:采用尿素为原料,在高锰酸钾催化剂 存在下,尿素和次氯酸钠-氢氧化钠溶液反应制 得:CO(NH2)2+ClO- +2OH-==N2H4+CO32-+Cl- +H2O
方法3:还可由氨、丙酮的混合物与氯气反应 的产物水解制取,同时得到联氨和丙酮:
4NH3 +(CH3)2CO + C12→(CH3)2C(N2H2) +2NH4Cl+H2O
(CH3)2C(N2H2) +H2O→(CH3)2CO+ N2H4
以上述信息考查氧化还原方程式、离子方程 式的书写等。
5.肼的主要用途
该物质用于制造异烟肼(又名雷米封)、照相 显影药剂、喷气式发动机燃料、火箭燃料、抗氧剂、 还原剂、高压锅炉给水脱氧剂等。如压水式核电 机组启动时,会向一冋路冷却剂中注人联氨以除 去水中的氧:
N2H4 +O2 =2H2O + N2
二、典例解析
例1 (2014年浙江省化学竞赛预赛)已知 二元化学物A可以用次氯酸钠和过量的氨气制 备,6.4 g A完全燃烧得到4.48 L 的氮气(已折算 成标准状况)。A可以与新制Cu(OH)2反应,生成砖红色沉淀,同时生成密度为1.25 g/L的无色 无味的气体(已折算成标准状况)。请回答下列 问题:
(1)A的化学式为 。
(2)写出次氯酸钠与过量的氨气反应生成的化学方程式 。在制备过程中需氨气过量的理由是__。
(3) 写出4与新制Cu(OH)2反应的化学方程式 。
(4) 已知在一定条件下可与等物质的量的 H2O2恰好完全反应得到B,化合物B与A所含元素相同,摩尔质量小于A,实验表明,B可能存在 两种同分异构体。
①B的化学式为 ;
②写出B的可能的两种同分异构体的结构式___
解析:
(1)根据计算二元化学物N、H物质 的最比,可得化学式为N2H4;
(2)根据制备原理配平可得:NaClO +2NH3 =N2H4 + NaCl + H2O;次氯酸钠有强氧化性,防止N2H4继续被氧化;
(3) 根据砖红色沉淀确定还原产物,可得:4Cu(OH)2 + N2H4=2Cu2O + N2 +6H2O;
(4)根据A可与等物质的量的H2O2恰好完全反应,且B与A所 含元素相同,可得B的分子式为N2H2则可推断合理电子式为![]() ,
,
顺反异构体为:
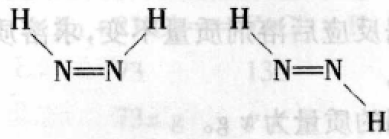
例2 (2015年高考模拟)肼(N2H4)又称联 氨,广泛用于火箭推进剂、有机合成及燃料电池, NO2的二聚体N2O4则是火箭中常用氧化剂。试回答下列问题:
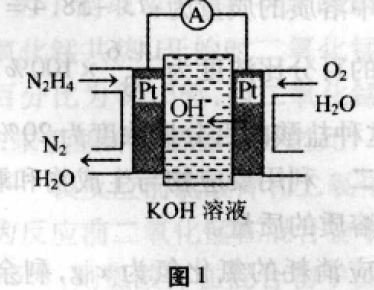
(1) 肼燃料电池原理如图1所示,左边电极 上发生的电极反应式为 。
(2) 火箭常用N2O4作氧化剂,胼作燃料,已知:
N2(g)+2O2(g)=2NO2(g) ΔH= -67.7kJ • mol-1
N2H4(g) +O2(g)=N2(g) +2H2O(g) ΔH= -534kJ • mol-1
2NO2(g) N2O4(g) ΔH= 一52.7kJ • mol-1
N2O4(g) ΔH= 一52.7kJ • mol-1
试写出气态胼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式____ 。
(3)联氨的工业生产常用氨和次氯酸钠为原 料获得,也可在高锰酸钾催化下,尿素 CO(NH2)2和次氯酸钠-氢氧化钠溶液反应获 得,尿素法反应的离子方程式为
解析
(1)为碱性条件下负极反应书写,遵 循得失电子守恒,电荷守恒、元素守恒,可得:N2H4-4e-+4OH-==N2 +4H2O;
(2)考查盖斯定律的运用,按序把三个方程式编为,①②③,②× 2-①-③,得2N2H4(g) +N2O4 (g)=3N2(g)+ 4H2O(g);ΔH= - 947. 6 kJ • mol-1)
(3)制备方法2:CO(NH2)2 十 ClO-+2OH-=N2H4 +CO32-+Cl- +H2O
三、巩固练习
在结构上N2H4和NH3的关系有如H2O2和 H2O的关系,试解答下列问题:
(1)N2H4能发生下列反应:
N2H4 + H3O+=N2H5++H2O
N2H4 + H2O=N2H5++OH-
N2H5++H2O=N2H62++OH-
N2H5++H2O=N2H4+H3O+
据此可得出的结论是 。
A.胼水解显酸性
B.肼在水中电离出H+
C. 胼是二元弱碱
D.胼是二元弱酸
(2) N2H4和H2O2分子中孤对电子数前者和后者的关系是 。
A.相等 B.大于 C.小于 D.无法确定
(3) 下列有关NH3、N2H4、H2O和H2O2性质叙述正确的是___ 。
A. H2O2热稳定性比H2O强
B. NH3热稳定性比水强
C.H2O2还原性比N2H4强
D. NH3结合质子的能力比水强
参考答案:(1)C (2) C (3) D

- 全部评论(0)
