解决化学平衡问题常用的3种思维方法
时间:2017-04-25 16:30 来源:未知 作者:张瀚 点击: 次 所属专题: 化学平衡解题思维
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1、虚拟法———“以退为进”原则
虚拟法,就是在分析或解决问题时,根据需要和可能,提出一种假设,找到一种中间状态,以此为中介(参照物)进行比较,然后再结合实际条件得出结论。其关键是虚拟出可以方便解题的对象,顺利实现由条件向结论的转化。
1)虚拟“容器”法
对于只有一种气体反应物的化学平衡的体系,浓度变化若从压强变化分析更为简单、容易。如A(g) B(g)+C(g)或A(g)+B(s)
B(g)+C(g)或A(g)+B(s)  C(g)+D(g),改变A的浓度,平衡移动方向可通过虚拟容器法建立中间状态,然后再从压强变化判断。
C(g)+D(g),改变A的浓度,平衡移动方向可通过虚拟容器法建立中间状态,然后再从压强变化判断。
例1 A、B、C、D为4种易溶于水的物质,它们在稀溶液中建立如下平衡:A+2B+H2O  C+D。当加水稀释时,平衡向________(填“正”或“逆”)反应方向移动,理由是________。
C+D。当加水稀释时,平衡向________(填“正”或“逆”)反应方向移动,理由是________。
解析:可将水虚拟为容器,将A、B、C、D 4种易溶物质虚拟为盛在“水———容器”中的气体物质。那么,加水稀释,“气体”的体积扩大,压强减小,根据勒夏特列原理,平衡向气体体积增大的方向,即上列平衡的逆反应方向移动。由此,可以得出结论:溶液稀释时,平衡向溶质粒子数增加的方向移动。
答案:逆;因为稀释后,单位体积内溶质的粒子总数(或总浓度)减小,根据勒夏特列原理,平衡向单位体积内溶质的粒子总数(或总浓度)增加的方向移动。
2)虚拟“状态”法
判断化学平衡移动的方向时经常用到以退为进的策略:先得到一个虚拟状态作为中介,然后再恢复到现实状况,进而得出相应的判断。如根据平衡移动的结果判断平衡移动的方向时,可先虚拟一个中间状态再进行判断,则移动方向不言自明。
例2 某温度下,在一容积可变的容器中,反应2X(g)+Y(g)  2Z(g)达到平衡时,X、Y和Z的物质的量分别为4mol,2mol和4mol,保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是( )。
2Z(g)达到平衡时,X、Y和Z的物质的量分别为4mol,2mol和4mol,保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是( )。
A 均减半 B 均加倍 C 均增加1mol D 均减少1mol
解析:按选项A、B方式投料,平衡与原来等效,不移动。按选项C方式投料,可将其虚拟为5mol X、2.5mol Y、5mol Z和0.5mol Y,正因为0.5mol Y的附加,使得平衡右移。按选项D方式投料,可将其虚拟为3mol X、1.5 mol Y、3 mol Z和-0.5molY,正因为-0.5 mol Y的附加,使得平衡左移。
答案 C。
2、极限法———可逆反应“不为0”原则
可逆性是化学平衡的前提,反应达到平衡状态时应是反应物和生成物共存的状态,每种物质的量不为0(可逆反应“不为0”原则)。但在处理化学平衡问题时,特别是在确定某些范围或在范围中选择合适的量时,往往可用极限分析法推断,即假设反应不可逆,则最多生成产物多少,有无反应物剩余,余多少。虽然这样的极值点是不可能达到的,却可以帮助我们确定某些数值的范围。
例3 在一定的反应条件下,某一可逆反应:A2(g) +3B2(g)  2C(g)达到了化学平衡状态,测得平衡时c(A2)=0.5 mol·L-1,c(B2)=0.1 mol·L-1,c(C)=1.6 mol·L-1。若A2、B2、C的起始浓度分别为amol·L-1、bmol·L-1、cmol·L-1,试回答:
2C(g)达到了化学平衡状态,测得平衡时c(A2)=0.5 mol·L-1,c(B2)=0.1 mol·L-1,c(C)=1.6 mol·L-1。若A2、B2、C的起始浓度分别为amol·L-1、bmol·L-1、cmol·L-1,试回答:
(1)a和b应该满足的关系是_____ 。
(2)a的取值范围是_______,理由是_______。
解析:(1)(a-0.5)/(b-0.1)=1/3;
(2)由平衡状态回推到起始状态:假若起始状态时没有C,即c(C)=0,则在完全反应时,要生成1.6 mol C,需A20.8 mol,B22.4mol,故起始状态,A2的最大量不能超过0.5mol+0.8mol=1.3mol。
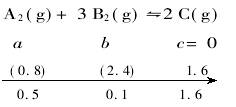
假若起始状态时没有B2,即c(B2)=0,则在完全反应时,要生成0.1 mol B2,需C 0.2/3 mol,当然,与此同时还会生成A20.1/3mol,故起始状态,A2的最小量不能低于0.5 mol-0.1/3 mol=1.4/3 mol。
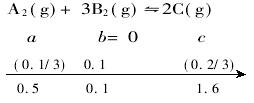
综上所述,a的取值范围是1.4/3<a<1.3。
3、等效法———“一边倒”原则
化工生产多为连续生产,往反应釜中投新料时,釜中往往还有部分反应物和产物存在,如何使得再次投料的结果与往空反应釜中投入反应物时一样,这就涉及到等效平衡问题。处理不同投料时达到相同平衡状态的等效平衡问题常用“一边倒”原则。“一边倒”原则的实质是极限法的进一步应用。首先我们要明白这样几个问题:
1)为什么要一边倒?
为便于比较不同投料时达到的平衡状态,需要转化成同等条件下才有可比性。即:若已知的投料是投反应物,则需把未知的投料情况一律转化成反应物;若已知的投料是产物,则需把未知的投料情况一律转化成产物;只有这样转化才能比较,否则失去意义。
2)如何倒?
根据化学方程式,理想化地认为反应物完全转化成产物或产物完全转化成反应物。
3)究竟倒向哪一边?
看已知的物质的量或物质的量浓度是左边的反应物的还是右边的产物的,以此为目标倒向该边。即倒向“参照物”那一边,倒后的量与“参照量”对应相等或成比例。
4)倒好以后,怎样才能称得上等效。
2种不同的投料情况,按照“一边倒”原则换算成相同的反应物或产物后,怎样才能称得上等效呢?还要看外界条件,在温度不变的情况下,又分为恒容和恒压2种情况:
恒容时,若反应前后气体分子数目不等,则倒后的量与“参照量”对应相等才能称得上等效平衡;恒容时,若反应前后气体分子数目不变,则只需倒后的量与“参照量”对应成比例即可称得上等效平衡。
恒压时,只需倒后的量与“参照量”对应成比例便可互称为等效平衡。
例4 在一固定容积的密闭容器中,保持一定温度,在一定条件下进行以下反应:A(g)+2B(g)  3C(g)。已知加入1 mol A和3molB,达到平衡后,生成了amolC。
3C(g)。已知加入1 mol A和3molB,达到平衡后,生成了amolC。
(1)上述反应达到平衡时C在反应混合气体中的体积分数是_______(用字母a表示)。
(2)在相同实验条件下,若在同一容器中改为加入2mol A和6mol B,达到平衡后,C的物质的量为________mol(用字母a表示)。此时C在反应混合气体中的体积分数_______填“增大”、“减小”或“不变”)。
(3)在相同条件下,若在同一容器中改为加入2mol A和8 mol B,若要在平衡后C在反应混合气体中的体积分数不变,则还应加入C_______mol。
(4)在同一容器中加入nmol A和3nmol B,则平衡时C的物质的量为_______mmol。若改变实验条件,可以使C的量在m~2m间变化。那么,n与m的关系是_______(用字母n、m表示)。
解析:(1)因为反应前后气体体积不变,即反应后混合气体物质的量总和仍为4 mol,所以C在反应混合气体中的体积分数(物质的量分数)是a/4;
(2)成倍投料时与(1)中平衡等效,即C在反应混合气体中的体积分数不变,但C的物质的量加倍,为2amol;
(3)设加入C的物质的量为xmol,则根据化学方程式按“一边倒”原则折算,相当于投入(2+x/3) mol A和(8+2x/3) mol B,则(2+x/3)/(8+2x/3)=1∶3,解得x=6
(4)可根据起始量、变化量、平衡量列“三部曲”式,结合“可逆反应不为0”原则,利用不等式确定n与m的关系:n>2m/3。
答案 (1)a/4;(2)2a,不变;(3)6;(4)3n>2m。
虚拟法、极限法、等效法是解决化学平衡问题时常用的3种方法,三者互为依托,彼此渗透,熟练掌握这些方法,对分析和解决化学平衡问题大有裨益。
链接练习
1.将1 mol二氧化硫和1 mol氧气通入一体积不变的密闭容器中,在一定温度下发生如下反应:2SO2+O2 2SO3,反应达到平衡时SO3为0.3mol。此时若移走0.5mol的O2和0.5mol的SO2,则反应达到新平衡时SO3的物质的量是( )。
2SO3,反应达到平衡时SO3为0.3mol。此时若移走0.5mol的O2和0.5mol的SO2,则反应达到新平衡时SO3的物质的量是( )。
A 0.3 mol; B 0.5 mol; C 大于0.15 mol,小于0.3 mol; D 小于0.15 mol
2.在恒温时,一固定容积的容器内发生如下反应:2NO2(g)  N2O4(g)达平衡时,再向容器内通入一定量的NO2(g),重新达到平衡后,与第一次平衡时相比,NO2的体积分数( )。
N2O4(g)达平衡时,再向容器内通入一定量的NO2(g),重新达到平衡后,与第一次平衡时相比,NO2的体积分数( )。
A 不变; B 增大; C 减小; D 无法判断
3.某温度下,一定量的混合气体在密闭容器中发生反应:mA(g)+nB(g) pC(g)达平衡后,将气体体积缩小到原来的1/2,当达到新平衡时,C的浓度为原来的1。9倍,其压缩过程中保持温度不变,则反应方程式中两边系数关系是( )。
pC(g)达平衡后,将气体体积缩小到原来的1/2,当达到新平衡时,C的浓度为原来的1。9倍,其压缩过程中保持温度不变,则反应方程式中两边系数关系是( )。
4.在一定温度下将1mol CO和1mol水蒸气放在密闭容器中反应:CO+H2O  CO2+H2,达平衡后测得CO2为0.6mol,再通入4mol水蒸气,达新平衡后CO2的物质的量可能是( )。
CO2+H2,达平衡后测得CO2为0.6mol,再通入4mol水蒸气,达新平衡后CO2的物质的量可能是( )。
A 0.6mol; B 1mol; C 0.8mol; D 1.2mol
5.下列可逆反应在某温度下于某容器内达到平衡状态:2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g),保持温度不变,压缩容器后,各物质仍然保持原来的物理状态达到新的平衡,讨论新平衡混合气体的平均摩尔质量比原平衡时混合气体的平均摩尔质量是增大,还是减小,还是不变。
CO(NH2)2(s)+H2O(g),保持温度不变,压缩容器后,各物质仍然保持原来的物理状态达到新的平衡,讨论新平衡混合气体的平均摩尔质量比原平衡时混合气体的平均摩尔质量是增大,还是减小,还是不变。
6.在固定体积的密闭容器中,加入2mol X和1mol Y,发生反应2X(g)+Y(g)  3Z(g)+W(g)达到平衡时,Z的浓度为amol·L-1。若维持容器体积和温度不变,按下列4种方法改变起始物质,达到平衡后,Z的浓度仍为amol·L-1的是( )。
3Z(g)+W(g)达到平衡时,Z的浓度为amol·L-1。若维持容器体积和温度不变,按下列4种方法改变起始物质,达到平衡后,Z的浓度仍为amol·L-1的是( )。
A.4mol X+2mol Y; B.2mol X+1mol Y+3mol Z+1mol W;
C.3mol Z+1mol W+1mol Y; D.3mol Z+1mol W
7.在一恒定的容器中充入2mol X和1mol Y发生反应:2X(g)+Y(g) xZ(g)达到平衡后,Z的体积分数为a%;若维持容器的容积和温度不变,按起始物质的量X为0.6 mol,Y为0.3mol,Z为1.4mol充入容器中,达到平衡后,Z的体积分数仍为a%,则x的值为( )。
xZ(g)达到平衡后,Z的体积分数为a%;若维持容器的容积和温度不变,按起始物质的量X为0.6 mol,Y为0.3mol,Z为1.4mol充入容器中,达到平衡后,Z的体积分数仍为a%,则x的值为( )。
A 只能为2; B 只能为3; C 可能为2,也可能为3; D 无法确定
8.恒温、恒压下,向可变容积的密闭容器中充入3 LA和2 LB,发生反应:3A(g)+2B(g)  xC(g)+yD(g)达到平衡时,C的体积分数是m%。维持温度和压强不变,将0.6 LA、0.4 LB、0.4 LC、0.8 LD作为起始物质充入密闭容器中,则达到平衡时C的体积分数仍为m%,则x∶y=(________)
xC(g)+yD(g)达到平衡时,C的体积分数是m%。维持温度和压强不变,将0.6 LA、0.4 LB、0.4 LC、0.8 LD作为起始物质充入密闭容器中,则达到平衡时C的体积分数仍为m%,则x∶y=(________)
链接练习参考答案:
1.D 2.C 3.m+n<p 4.c 5.均有可能。 6.d 7.c 8.1∶2

- 全部评论(0)
