晶体计算难题例析
时间:2016-01-30 14:15 来源:未知 作者:康建峰 点击: 次 所属专题: 晶体结构计算
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
晶体的有关计算是高考的热点,又是教学的难点。本文利用晶体的数学模型,构建宏观体积、质量、密度与微观粒子的数目、占有的体积、质量等的关系及确定晶胞所拥有的原子数。深入认识和准确把握晶体的特点。
[例1] 食盐晶体是由钠离子和氯离子组成的,且均为等距离的交错排列。已知食盐的密度是2.2g/cm3,阿伏加德罗常数为6.02×1023mol-1。在食盐晶体中两个距离最近的钠离子中心间的距离最接近于( )。
A.3.0×10-8cm B.3.5×10-8cm C.4.0×10-8cm D.5.0×10-8cm
解:根据均摊原则计算一个晶胞拥有的离子数:1.立方体中处于顶点的粒子,同时为8个晶胞所共有,每个粒子有1/8属于该晶胞;2.处于棱上的粒子,同时为4个晶胞所共有,每个粒子有1/4属于该晶胞;3.处于表面上的粒子,同时为2个晶胞所共有,每个粒子有1/2属于该晶胞;4.处于该晶胞内部的粒子,则完全属于该晶胞。
由此计算,在一个氯化钠晶胞中,拥有4个钠离子和4个氯离子。
如右图,设该晶胞的边长为A,两个距离最近的钠离子中心间的距离为B,则

方法一:依据1mol 氯化钠固体的体积建立等量关系式。
1mol 氯化钠的质量为58.5g,由密度得体积为58.5g/2.2g·cm3,1mol 氯化钠含有的晶胞数为NA/4,一个晶胞的体积是a3,故1mol 氯化钠的体积是NA·a3/ 4。即:
58.5g/2.2g·cm3=NA·a3/ 4
a=5.6×10-8 cm
b=![]() a/2=4.0×10-8cm
a/2=4.0×10-8cm
方法二:依据1个氯化钠晶胞的质量建立等量关系式。
58.5g×4/ NA=2.2g·cm3·a3
a=5.6×10-8cm
b=![]() a/2=4.0×10-8cm
a/2=4.0×10-8cm
方法三:依据1mol 氯化钠固体的密度建立等量关系式。
2.2g·cm3=58.5g×4 / NA a3
a=5.6×10-8cm
b=![]() a/2=4.0×10-8cm
a/2=4.0×10-8cm
此题关键是掌握体积、密度、质量与物质的量、微粒数之间的计算关系。从不同的角度认识同一问题,有利于深化理解,灵活运用。
[例2]最近发现一种钛原子和碳原子构成的气态团簇分子,如图所示,顶角和面心的原子是钛原子,棱的中心和体心的原子是碳原子,它的化学式为 。

[解] 由于钛原子和碳原子构成的是单个气态团簇分子,是分子晶体,边界原子不会分摊,都属该分子拥有,故它的化学式为Ti14C13。
很多同学不注意审题,以为与氯化钠离子晶体相似,结果计算出Ti4C4的错误结果。
[例3] 石墨的结构如课本所示,已知石墨的密度2.22g/cm3,石墨晶体的层状结构中C—C键键长为1.43×10-10m,试求石墨晶体中的层间距。(已知六棱柱体积公式为:1/2×6sin60°×a2×b)

[解] 从石墨晶体中选取一个六棱柱(如图),六棱柱中每个碳原子被6个六棱柱共用,所以,一个六棱柱所拥有的碳原子数为12×1/6=2。
石墨中六棱柱的体积为V=1/2×6sin60°×(1.43×10-10)2×b
石墨中每个六棱柱所拥有的碳的质量为2×12g·mol-1/6.02×1023mol…1
由石墨的密度可得:
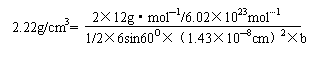
故 b=3.38×10-8cm=3.38×10-10 m。
即石墨晶体中的层间距为3.38×10-10 m
石墨是片层结构,通常的习题中是确定在同一层内,每个六边形所拥有的碳原子数,只考虑同一层时,每个六边形所拥有的碳原子数为2(每个碳与另外三个碳相连,实际拥有1/3,6×1/3=2),往往容易认为一个六棱柱所拥有的碳原子数为4,这样计算出错。
晶体的计算的难点主要是晶体数学模型的构建和宏观体积、质量、密度与微观粒子的数目、占有的体积、质量等的关系及确定晶胞所拥有的原子数。只要掌握这些特点,思维的深刻性、敏捷性就会不断提高。

- 全部评论(0)
